大家好,今天要和大家分享的是今年二月份发表在Cancer Cell (IF:26.602)上的一篇文章,“An Integrated Gene expression Landscape Profiling Approach to Identify Lung Tumor Endothelial Cell Heterogeneity and Angiogenic Candidates”,作者使用单细胞RNA测序研究了人类和小鼠非小细胞肺癌的肿瘤内皮细胞(TEC)表型,探究了不同表型之间的功能以及跨物种的保守性,发现特定的TEC表型与抗血管生成治疗的预后和反应有关,并通过实验验证了特定的抗血管生成物与保守的TEC表型关系。
An Integrated Gene expression Landscape Profiling Approach to Identify Lung Tumor Endothelial Cell Heterogeneity and Angiogenic Candidates
通过整合基因组分析以鉴定肺肿瘤内皮细胞异质性和血管生成候选物
一、文章背景
在视网膜血管化模型的血管芽生过程中,内皮细胞(EC)的发育存在异质性:tip EC导引血管出芽,而stalks EC的增生则延长了血管。tip EC和stalks EC并非预先由基因决定,而是可动态互换的表型。
在患者,物种间和模型间的单细胞水平上肿瘤EC(TEC)的转录组异质性尚未在单项研究中分析进行盘点。
在肿瘤血管生成领域,一些单细胞RNA测序(scRNA-seq)研究汇总了先前已知的TEC表型进行描述,但并没有研究确定这些亚型与经过功能验证的血管生成候选物之间的关联性。与此同时,有人质疑一种肿瘤类型的单个scRNA-seq研究是否足够去探究确定血管生成候选物,因为在一项研究中,在2种人类结肠癌异种移植模型中的tip EC表达了不同的标志物。
作者希望克服物种和模型相关的变异性,使用了scRNA-seq,以及正交多组学方法进行验证,以识别患者,肿瘤类型,物种、个体和模型之间的保守表型和标记模型,以探究亚型与血管生成相关的标志物功能与保守型以及可能存在的预后相关性。
二、文章思路
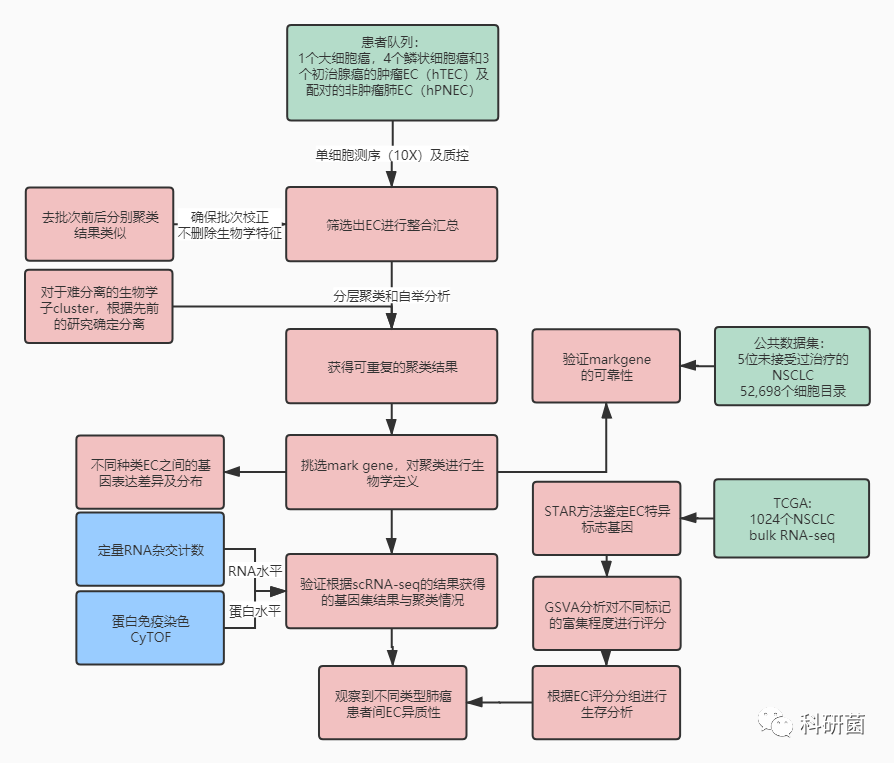
人类肺癌中EC
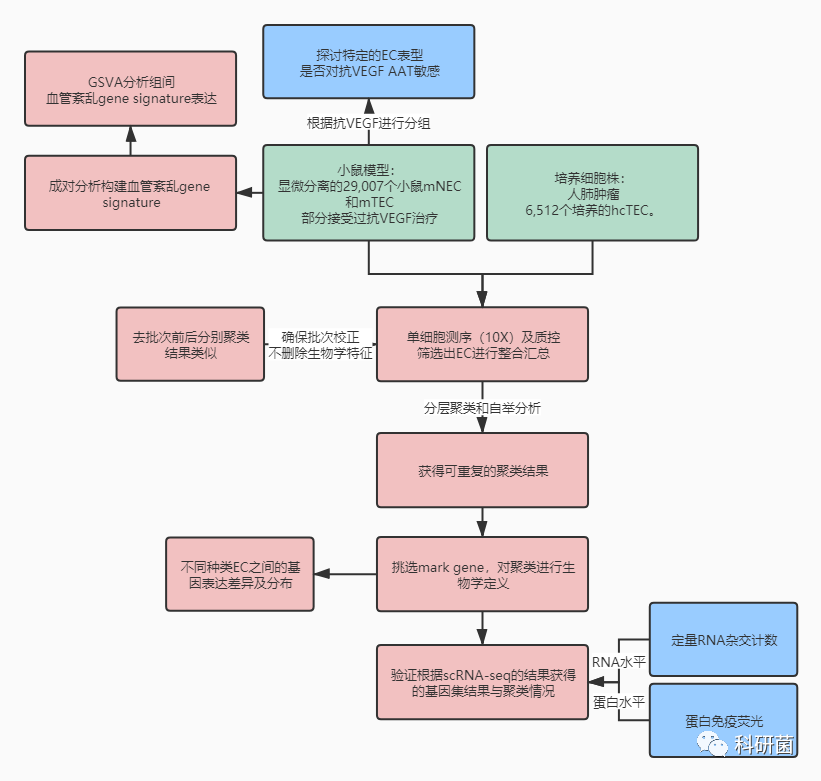
常用model中EC
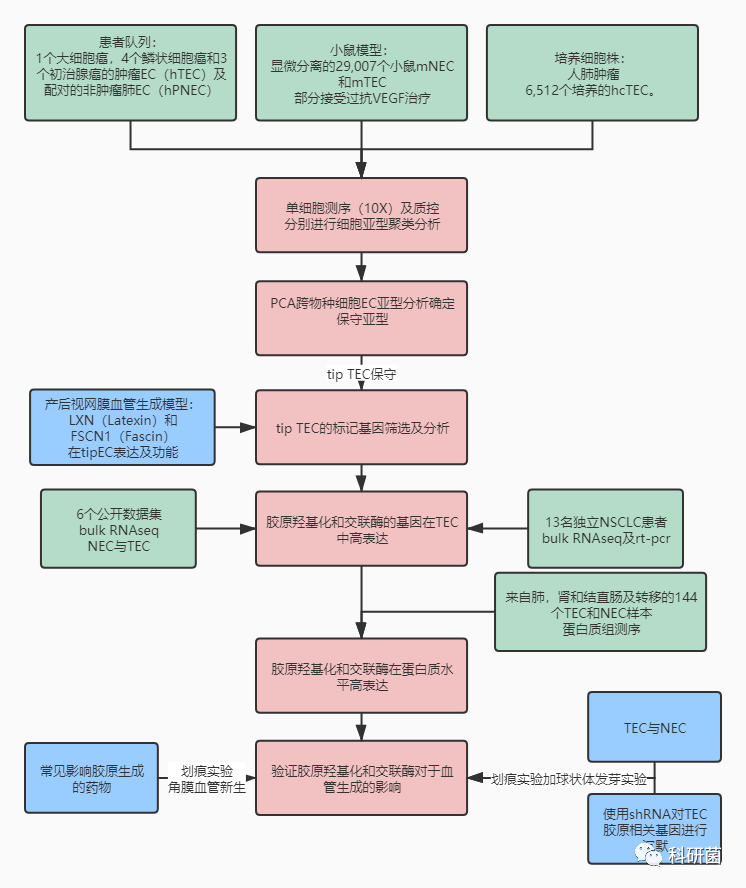
保守表型及标志物鉴定&靶标筛选
三、结果解读1.人类肺癌中EC表型的单细胞图谱
作者主要针对人类非小细胞肺癌(NSCLC)进行研究:
对来自1个大细胞癌患者,4个鳞状细胞癌患者和3例初治腺癌的新鲜分离的人类肿瘤EC(hTEC)和配对(样本来源患者)的人类腹膜外非肿瘤性肺EC(human pulmonary EC-hPNEC)进行了分析。
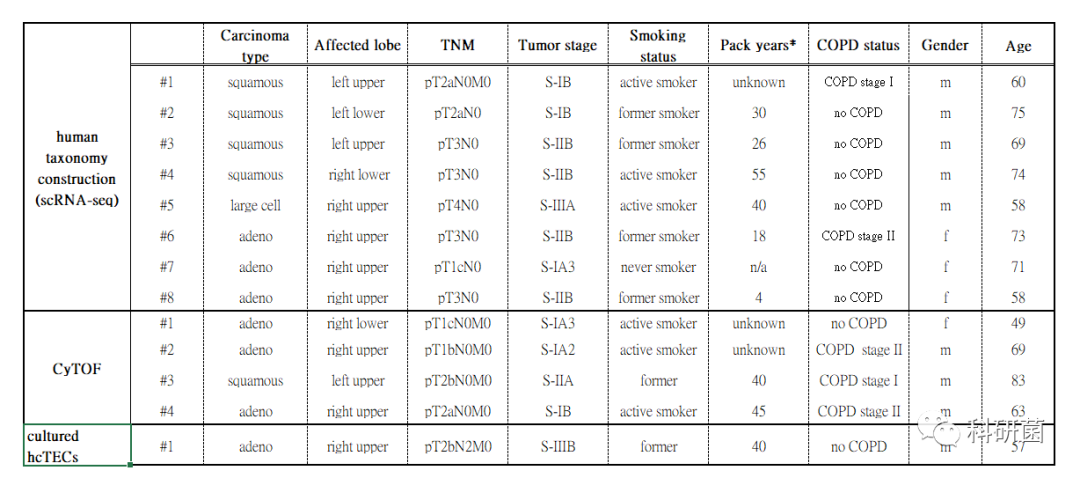
附表1:研究中提供样本的患者的基线特征
作者对单细胞悬液使用磁性激活细胞分选(MACS) EC(图1A),并使用10X scRNA-seq。在对检测到的基因数量和线粒体读数进行质量过滤后,评估重复数据,并根据文库大小对转录本读数进行标准化(STAR方法)。
筛选出测序细胞中的EC(图S1A和S1B),并使用t-SNE图对来自8位患者的多达12,323 hTEC和8,929 hPNEC转录组进行汇总,批处理校正,聚类和可视化(图1B,1C和S1C)。
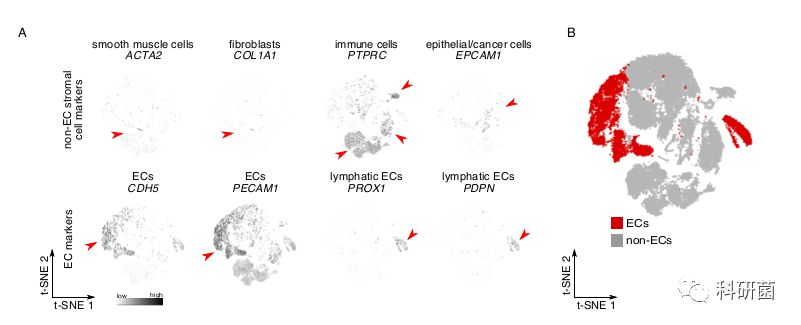
附图1A:t-SNE聚类后的亚群注释
附图1B:t-SNE图中的内皮细胞
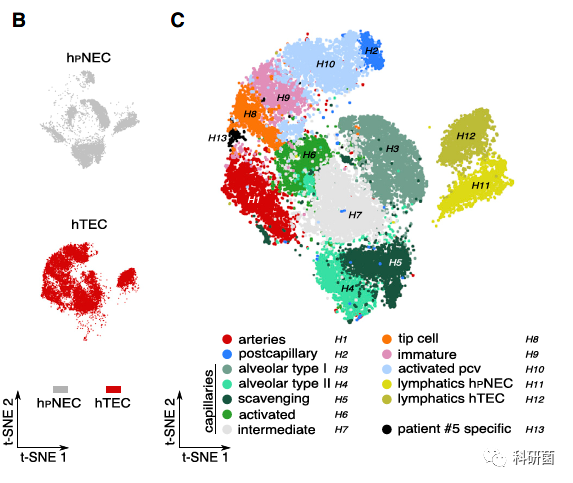
图1B:hpNEC和hTEC的t-SNE图
图1C:整合后的t-SNE图(对不同亚群进行颜色注释)
为了确保批次校正不会删除相关的生物学特征,作者分别分析了每个样品,发现在批处理校正后的数据中检测到的聚类与未进行批处理校正所获得的聚类非常相似。为了评估簇的可重复性,作者进行了分层聚类和自举分析(图S1D)
3 4 5

