SMYD3是一种参与癌细胞增殖的组蛋白甲基转移酶
SMYD3是一种参与癌细胞增殖的组蛋白甲基转移酶01文章背景简介BACKGROUND INTRODUCTION在发达国家,结直肠癌(CRC)是导致癌症死亡的主要原因。2000年,将
01
文章背景简介
BACKGROUND INTRODUCTION
在发达国家,结直肠癌(CRC)是导致癌症死亡的主要原因。2000年,将近940,000人被诊断为CRC,约有579,000人死于CRC。肝癌(HCC)也是一种最常见的世界性恶性肿瘤,特别是在亚洲和非洲。在过去的几年里,对于CRC和HCC的分子机制取得了很大进展,包括组蛋白修饰在其中发挥的作用。
组蛋白修饰在染色质结构的调节以及转录激活和抑制中起作用。组蛋白修饰发生在特定的残基中,这些修饰以组合或顺序、单尾或多尾方式起作用。在这些修饰中,组蛋白H3中赖氨酸残基4位、9位、27位和36位上的甲基化,以及H4中赖氨酸残基20位、20位上的甲基化是转录调控的关键。此外,与其他组蛋白修饰(如乙酰化或磷酸化)相比,组蛋白甲基化似乎更稳定,可为长期转录记忆提供表观遗传标记。组蛋白H3(H3-K4)的赖氨酸4位甲基化对转录激活很重要。然而,组蛋白甲基化和转录调控的确切机制仍不清楚。
含有SET结构域的蛋白质组成一个家族,并根据结构或序列相似性至少分为四组。其中,SUV39蛋白 - 果蝇的哺乳动物同源体-位置效应变异修饰因子Su(var)3-9具有H3-K9甲基转移酶活性。Set1和Set2分别具有H3-K4或H3-K36甲基转移酶活性,而G9a作为“双倍的 ”甲基转移酶起作用,催化组蛋白H3-K9和H3-K27。此外,SET7/9在H3-K4上具有特异性的组蛋白甲基转移酶(HMTase)活性,并对该位点进行单甲基化和二甲基化。虽然许多SET结构域蛋白在组蛋白修饰中起作用,但它们如何调节转录仍不清楚。
日本东京大学Ryuji Hamamoto 等人,于2004年4月在《NATURE CELL BIOLOGY》(IF14.01,生物 1区)发表,题为“SMYD3 encodes a histone methyltransferase involved in the proliferation of cancer cells”。本研究报告了SMYD3的基因结构和表征。SMYD3是一个含有SET结构域的人类基因,并且在CRC和HCC中高表达。SMYD3在HSP90A(热休克蛋白)存在下甲基化组蛋白H3-K4并激活包括Nkx2.8在内的下游基因的转录。这一研究表明SMYD3可以作为治疗这些肿瘤的新分子靶点。
02
所用到的主要方法
METHODS
1.RT-PCR
2.菌落形成测定
3.免疫沉淀试验
4.体外组蛋白甲基转移酶测定
5.染色质免疫沉淀(ChIP)测定
03
文章主要内容摘要
ABSTRACT
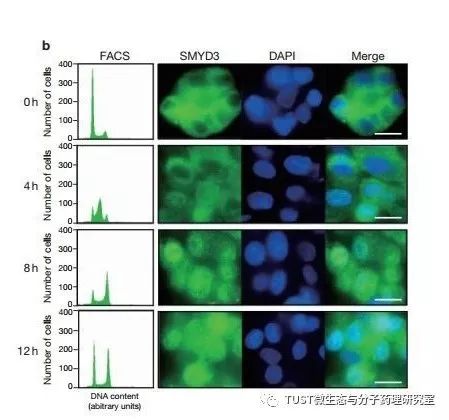
结直肠癌和肝癌是世界范围内癌症死亡的主要原因之一,但这些恶性肿瘤的机制尚不完全清楚。本篇文章对SMYD3进行研究,SMYD3是一种在大多数结直肠癌和肝细胞癌中过表达的基因。将SMYD3导入NIH3T3细胞(小鼠胚胎成纤维细胞)可增强细胞生长,而通过小干扰RNA(siRNA)对SMYD3进行基因敲低可显著的抑制癌细胞的生长。SMYD3在RNA解旋酶HELZ的作用下可与RNA聚合酶II形成复合物,并反式激活一组基因,包括癌基因、同源盒基因和与细胞周期调节相关的基因。SMYD3与5'-CCCTCC-3'基序结合,存在于下游基因如Nkx2.8的启动子区域。SMYD3的SET结构域显示出组蛋白H3-赖氨酸4位(H3-K4)特异性甲基转移酶活性,其在热休克蛋白HSP90A存在下增强。我们的研究结果表明SMYD3具有组蛋白甲基转移酶活性,并且作为RNA聚合酶复合物的成员在转录调节中起重要作用。 此外,SMYD3的激活可能是人类癌症发生的关键因素。
▼相关链接▼Smyd3是多种促癌基因的转录增强剂并为肝癌和结直肠癌发展提供帮助
-
FDA批准首款培非格司亭生物类似药,治疗癌症并发症2019-06-04
-
科普1分钟 | 剖析吸尘器的心脏:一眼看穿电商产品介绍的猫腻2019-05-28