CNS前沿文献追踪–微丝调控杀伤性T细胞脱颗粒
CNS前沿文献追踪–微丝调控杀伤性T细胞脱颗粒杀伤性T细胞(CTL)识别靶细胞形成免疫突触后会脱颗粒,通过穿孔素、颗粒酶杀灭靶细胞,此次整理分享一篇文章,看一下CTL脱颗粒之后是如

杀伤性T细胞(CTL)识别靶细胞形成免疫突触后会脱颗粒,通过穿孔素、颗粒酶杀灭靶细胞,此次整理分享一篇文章,看一下CTL脱颗粒之后是如何“停火”的。具体内容如下:
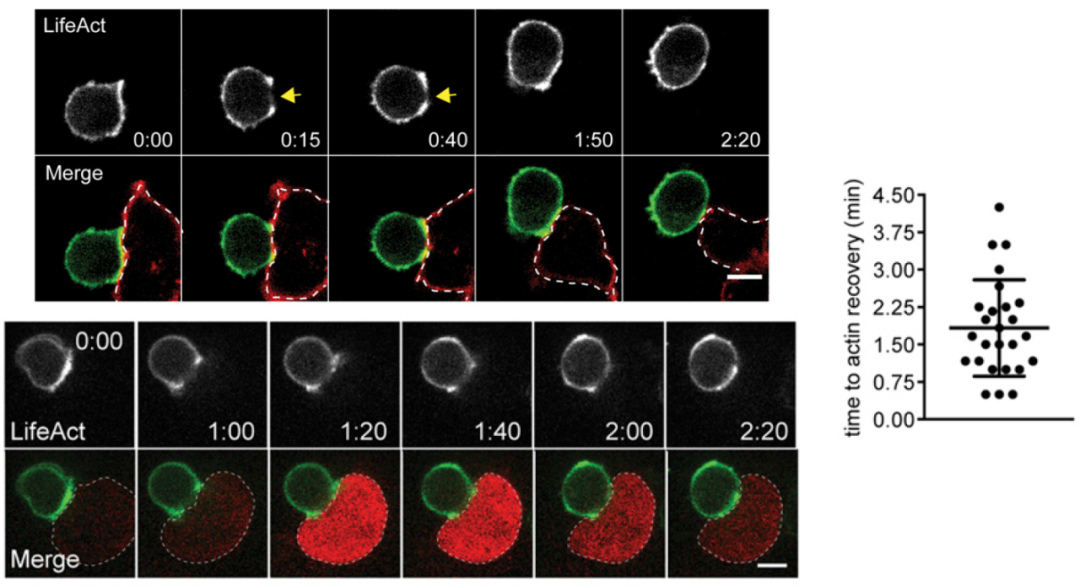
作者首先追踪了CTL和靶细胞接触后微丝的变化,发现:CTL接触靶细胞后接触点处微丝(绿色)密度会下降,而后又恢复;接触点微丝密度的降低是伴随着靶细胞膜破损发生的(上图红色标记的是靶细胞膜;下图红色是靶细胞表达了Ca2+感应蛋白,当靶细胞膜破损后钙离子内流,细胞变红)
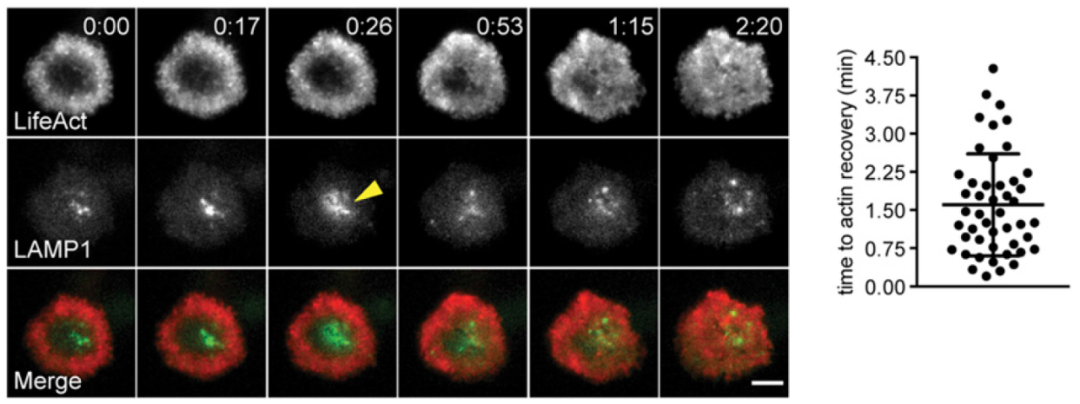
靶细胞膜破损和CTL脱颗粒有关,所以作者又同时追踪了一下脱颗粒(穿孔素、颗粒酶由溶酶体释放,所以作者追踪的溶酶体,用的是溶酶体marker LAMP1)和微丝行为,发现微丝密度降低是伴随着脱颗粒发生的,当脱颗粒逐渐完成,微丝密度恢复 – 暗示微丝给脱颗粒“让路”,脱完颗粒微丝恢复
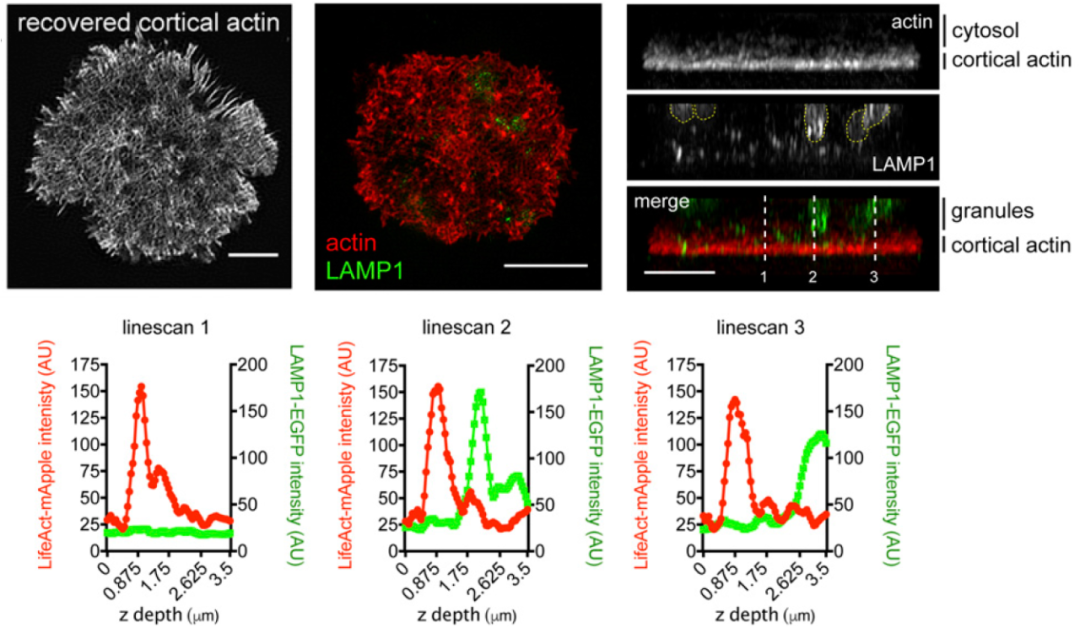
作者又用SIM超分辨,在脱完颗粒、微丝恢复的细胞上看了一下微丝和溶酶体的关系,发现:恢复后的微丝挡住了溶酶体,暗示恢复后的微丝可物理分隔CTL效应分子和靶细胞
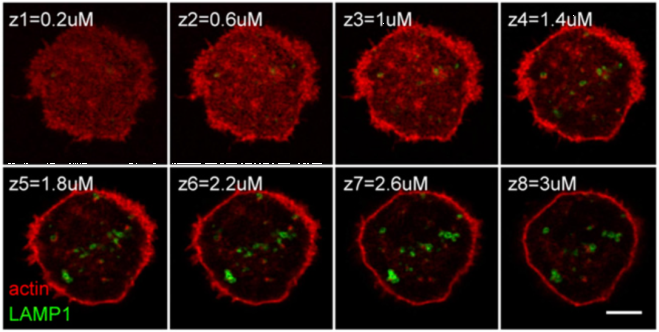
也用共聚焦看了一下,依然发现在离开微丝一定距离处才有溶酶体分布,再次暗示微丝阻隔溶酶体
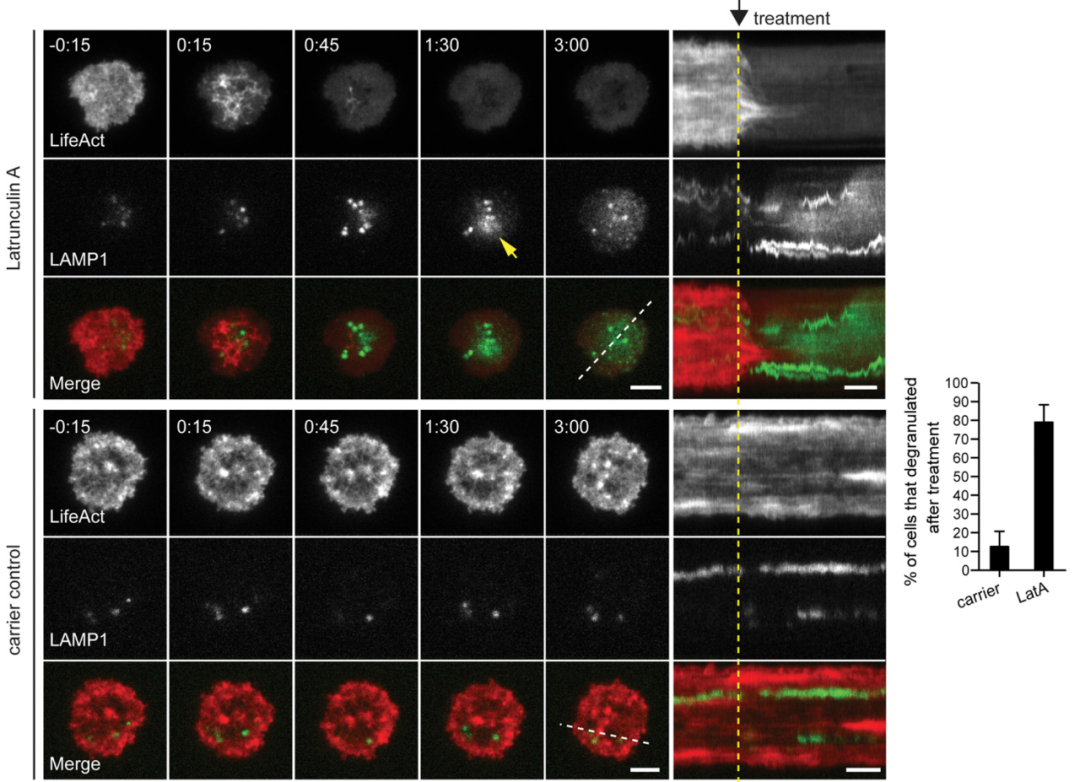
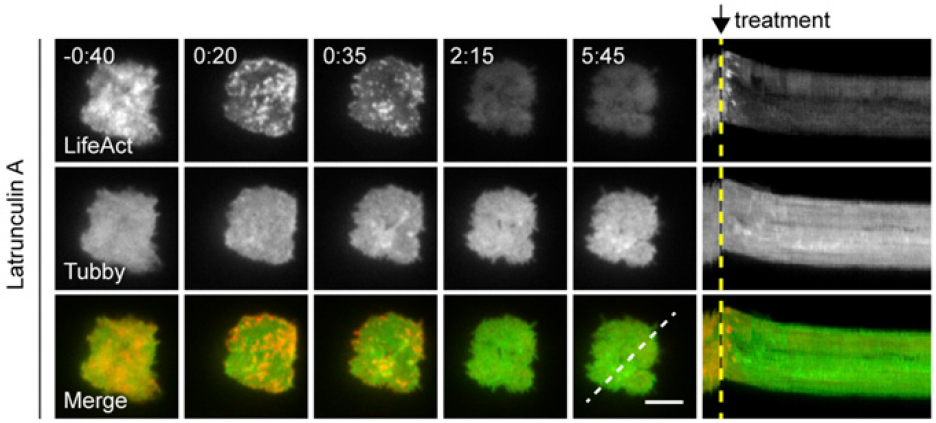
实际验证一下微丝阻隔溶酶体,怎么验证呢?用微丝解聚药latrunculin A抑制微丝(红色)后发现CTL脱颗粒(绿色)增加,说明微丝的确是有阻挡脱颗粒的作用
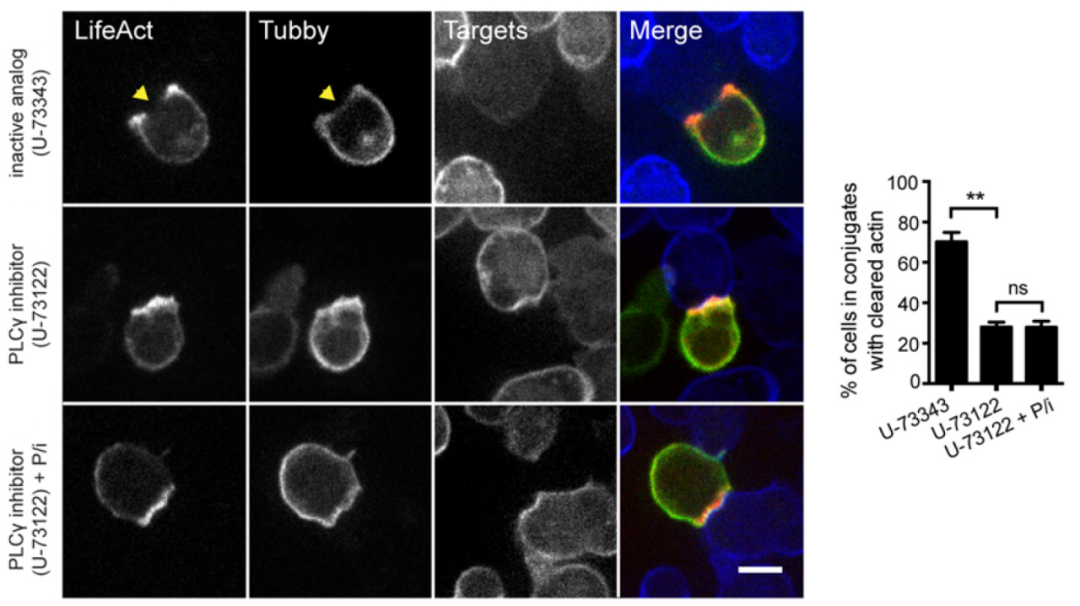
微丝有调控脱颗粒的作用,那什么在免疫突触附近调控微丝呢,查阅文献发现PIP2有相关作用,实际看一下:PLCγ1是种磷脂酶,可将PIP2转化为IP3和DAG,使用PLCγ抑制剂U-73122(U-73343算是阴性对照)阻断PIP2(绿色)降解后微丝密度(红色)不再降低,暗示PIP2和微丝密度降低相关;PLCγ被抑制后PIP2是不会少了,但IP3、DAG会变少,为了排除这两种产物的影响,作者在PLCγ抑制组有加了P/i(PMA和ionomycin) rescue IP3、DAG的缺陷,发现并不会引起微丝密度降低,说明不是IP3、DAG调控的免疫突触附近微丝密度降低 – 综合起来暗示TCR被激活后PLCγ调控PIP2,进而影响微丝
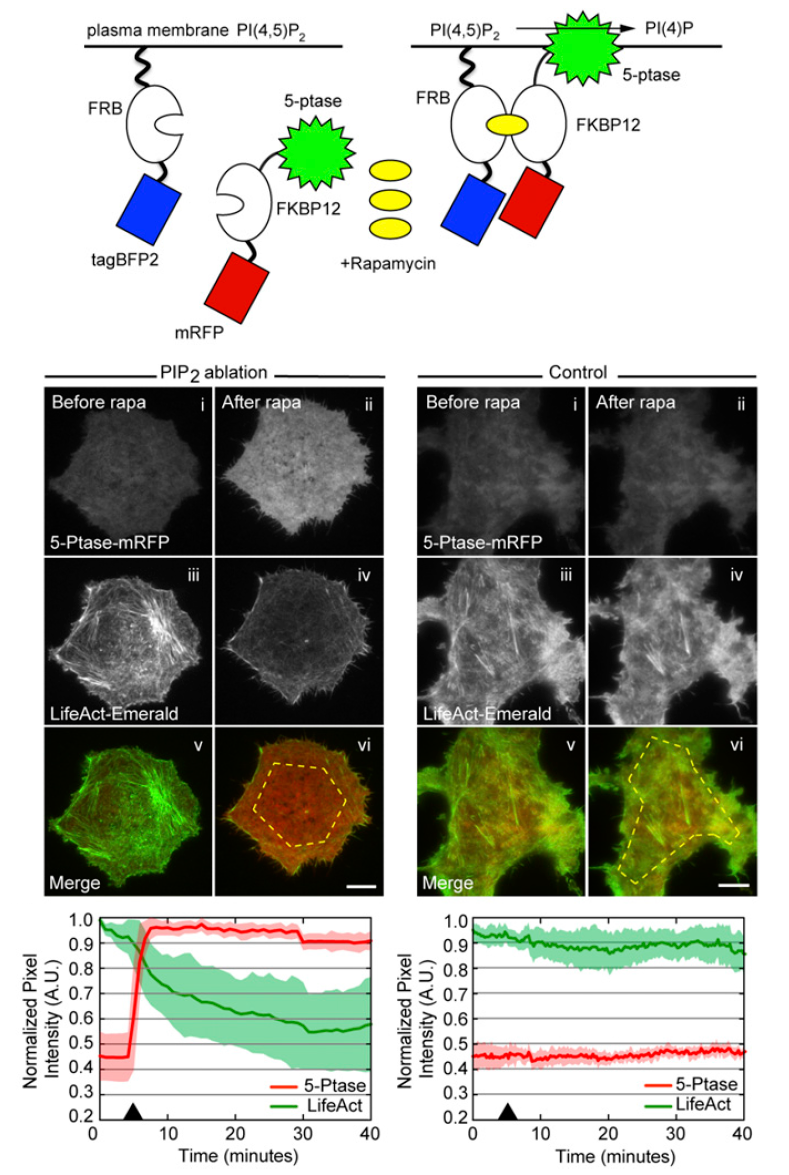
换个系统继续看PIP2对微丝的影响:作者构建了一个雷帕霉素诱导召集可转化PIP2酶的系统,加入雷帕霉素后成功召集了5-Ptase,可见随着5-Ptase的召集增加,微丝密度下降,再次暗示PIP2和微丝密度的相关性
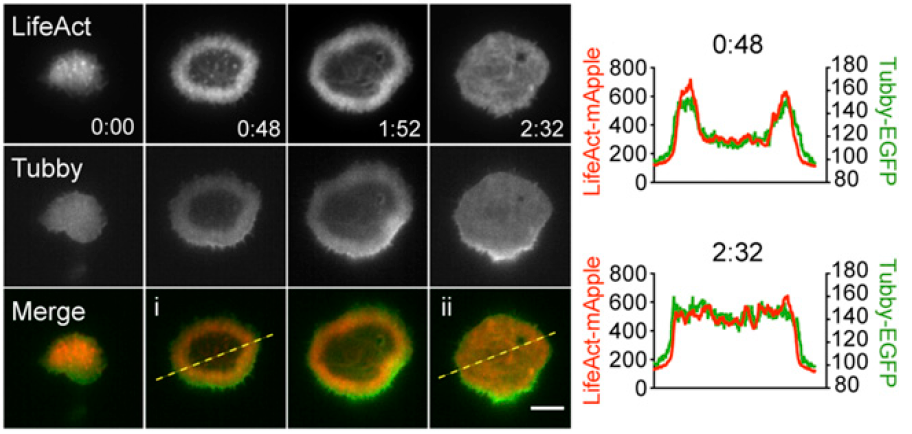
前面看了PIP2降微丝密度跟着降,脱颗粒后微丝密度会恢复,微丝恢复后PIP2怎么变呢?实际看一下,发现微丝恢复PIP2也恢复
“搞”PIP2微丝跟着变,“搞”微丝PIP2会如何呢?用药物解聚微丝后,发现PIP2水平并没发生变化,暗示PIP2在微丝的上游调控微丝
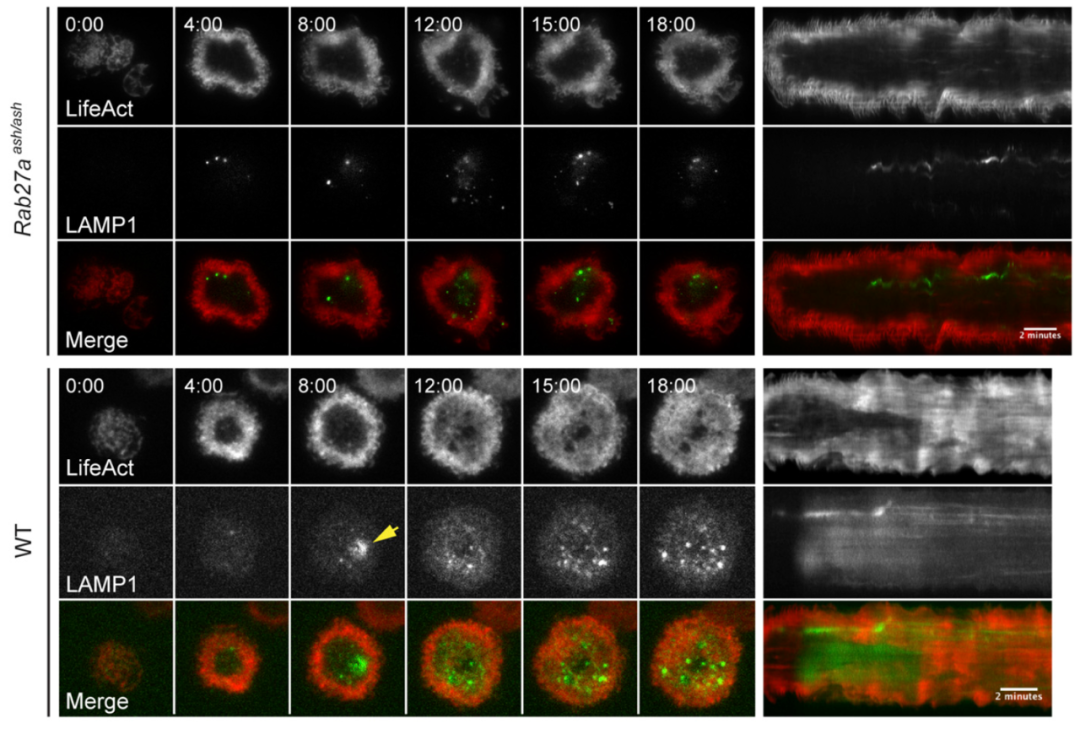
脱颗粒时微丝密度降低,脱完微丝密度恢复,暗示脱颗粒也会调控微丝,作者在脱颗粒缺陷的细胞(Rab27a缺陷)上观察微丝行为,发现虽然细胞无法脱颗粒,但微丝密度仍然会下降,且无法恢复 – 暗示颗粒酶、穿孔素的分泌会影响微丝密度的恢复
挺简单,观察了CTL发射“炮弹”前后微丝的行为,发现了几个调控微丝的因素(PIP2、颗粒酶穿孔素的释放),但这些因素如何联动并不知道,并没有挖到互作层面,理清分子链条 – 可以做,但不知道有没有人做过,毕竟这是篇2017年的文章。不过不妨碍“细胞生物学发现一些细胞行为的关联,分子生物学去找关联细胞行为的分子链条”这一思路对科研工作的指导……
Alex T. Rittera, Senta M. Kapnickc, Sricharan Murugesand, Pamela L. Schwartzbergc, Gillian M. Griffiths and Jennifer Lippincott-Schwartza,. Cortical actin recovery at the immunological synapse leads to termination of lytic granule secretion in cytotoxic T lymphocytes [J]. PNAS, July 17, 2017.
想了解更多CNS级期刊最新内容,请关注我们的公众号,常有更新哦,也可加笔者微信交流:qianle522568 01
此次文章交流会
主题:CNS前沿文献追踪 – 病毒衣壳在细菌内部的运动模式
时间:9月2日 周三 19:00 - 20:00
主讲人:于博士
文章链接:https://mp.weixin.qq.com/s/fyN_cSePwt5xSieF_6F7HQ
会议 ID:207 800 506
参会软件:腾讯会议app
也欢迎您准时参会- 点击“阅读原文”链接直接加入会议
参考文献:
Vorrapon Chaikeeratisak, Kanika Khanna, Katrina T. Nguyen, Joseph Sugie, et al. Viral Capsid Trafficking along Treadmilling Tubulin Filaments in Bacteria [J].Cell. 2019.
2019-2020年CNS文献汇总
【CNS前沿文献追踪】内溶酶体调节凋亡
【CNS前沿文献追踪】追踪程序性坏死过程中MLKL行为
【CNS前沿文献追踪】呼吸道合胞病毒RSV进入细胞新机制
【CNS前沿文献追踪】CO位置影响减数分裂过程中染色体分离
【CNS前沿文献追踪】SKP1驱动减数分裂由前期向中期过渡
【CNS前沿文献追踪】SPO16调节减数分裂的机制
【CNS前沿文献追踪】Ded1p通过相变调节细胞翻译状态
【CNS前沿文献追踪】RNA通过改变G3BP1构象驱动相变进行
【CNS前沿文献追踪】Sup35在应激条件下通过相变保护细胞
【CNS前沿文献追踪】相变影响核小体泛素化
【CNS前沿文献追踪】细胞核内脂滴的形成
【CNS前沿文献追踪】过氧化物酶体、脂滴调控脂肪分解机制
【CNS前沿文献追踪】SIM超分辨看DNA损伤修复过程中γH2AX
【CNS前沿文献追踪】Amo1蛋白调节异染色质核内定位及基因沉默
【CNS前沿文献追踪】组蛋白甲基化reader ZCWPW1调节减数分裂
【CNS前沿文献追踪】用SIM观察减数分裂过程中DNA修复、联会、交叉互换
【CNS前沿文献追踪】小分子化药联用触发NK肿瘤免疫反应
【CNS前沿文献追踪】提高肿瘤免疫疗法敏感度的新靶点ADAR1
【CNS前沿文献追踪】调节T细胞疲劳的转录因子NR4A
【CNS前沿文献追踪】调节DC细胞抗原提呈的mRNA甲基化读取蛋白YTHDF1
【CNS前沿文献追踪】改造巨噬细胞用于肿瘤诊断
【CNS前沿文献追踪】MDSC进入肿瘤微环境的一种机制
【CNS前沿文献追踪】T细胞诱导肿瘤细胞发生铁死亡
【CNS前沿文献追踪】用小分子化药控制CART
【CNS前沿文献追踪】细胞凋亡被吞噬后溶酶体的再形成
【CNS前沿文献追踪】病毒衣壳在细菌内部的运动模式
【CNS前沿文献追踪】线虫身体延长分子机制
【CNS前沿文献追踪】WDFY2通过VAMP3抑制基质金属蛋白酶再循环
【CNS前沿文献追踪】死亡受体Fas的内体调节
【CNS前沿文献追踪】用TIRF-SIM看TCR信号
【CNS前沿文献追踪】53BP1稳定染色质的机制
【CNS前沿文献追踪】用电转导入荧光标记抗体进行活细胞超分辨成像
【CNS前沿文献追踪】用SIM观察减数分裂过程中DNA修复、联会、交叉互换
-
华为申请机器人新专利:模拟眼球运动,提高追踪准确性及拟人化程度2020-08-25
-
华为机器狗曝光:采用AI技术 可做到动态多目标追踪、追随2020-08-25
-
华为申请机器人新专利:模拟眼球运动提高追踪准确性及拟人化程度2020-08-24
-
华为机器狗曝光:采用AI技术 可做到动态多目标追踪、追随2020-08-24
-
iOS13.5正式版推送,增加口罩探测、新冠密切接触追踪等功能2020-05-21
-
苹果推送iOS13.5正式版,新增戴口罩解锁和新冠密切接触追踪功能2020-05-21
-
AI人形追踪居家看护好帮手 创维小湃智能摄像头评测2020-04-30
-
“不要GPS”:谷歌和苹果罕见联手,用蓝牙匿名追踪病毒接触者2020-04-17
-
美国病例超50万!苹果谷歌确认Android和iOS设备可互通 追踪新冠病毒患者2020-04-11
-
苹果的追踪硬件AirTag真的要来了,官方视频自证2020-04-03
-
英伟达安培显卡采用三星10nm工艺,支持光线追踪2020-03-14
-
人工智能助力疫情 大数据技术筛查深挖追踪接触者2020-03-09
-
基于蜂窝物联网的供应链追踪器为资产运输提供可信环境和状态数据2020-02-27
-
预警潜在患者、追踪重点车辆,海信让“抗疫”更有智慧2020-02-19
-
追踪和预测新冠病毒传播点,技术做了什么?2020-02-13