单细胞新替代方案不贵但发了10分
单细胞新替代方案不贵但发了10分题目:结直肠癌中肿瘤浸润性CD8 + T细胞在早期与晚期的基因表达差异及预后不良的基因特征的鉴定一、研究背景细胞毒性CD8 + T细胞介导的反应是适
题目:结直肠癌中肿瘤浸润性CD8 + T细胞在早期与晚期的基因表达差异及预后不良的基因特征的鉴定
一、研究背景
细胞毒性CD8 + T细胞介导的反应是适应性免疫的最重要组成部分,它决定了宿主免疫反应在消灭肿瘤细胞中的能力。由于肿瘤的内在和/或外在因素,CD8 + TILs的密度和功能可能受到损害,导致不良的预后和生存。而CD8 + TILs水平升高与CRC患者的总体生存期延长和无复发生存期有关,而与疾病阶段无关,这表明它们可能是预后改善的指标。
二、研究流程
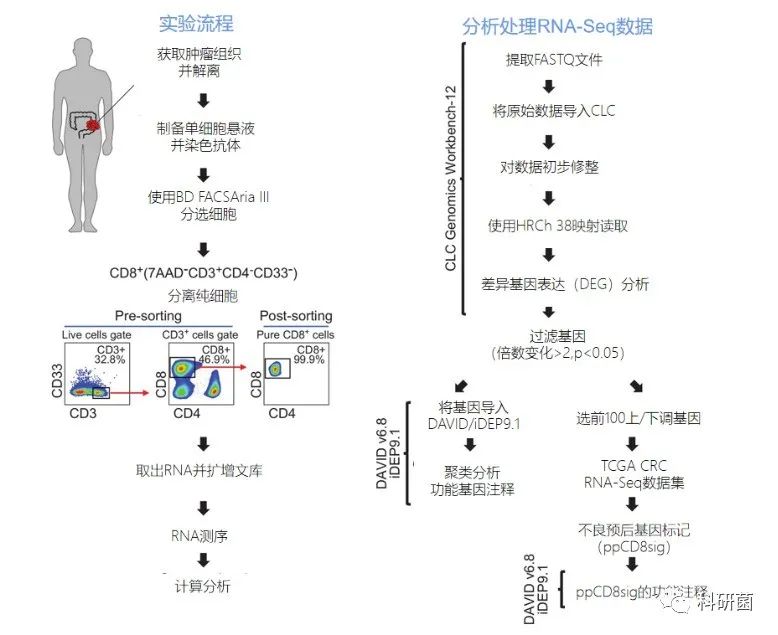
分阶段步骤详解:
三、结果解读
1、早期与晚期阶段的CRC TIL CD8+ T细胞转录组形成不同的聚类
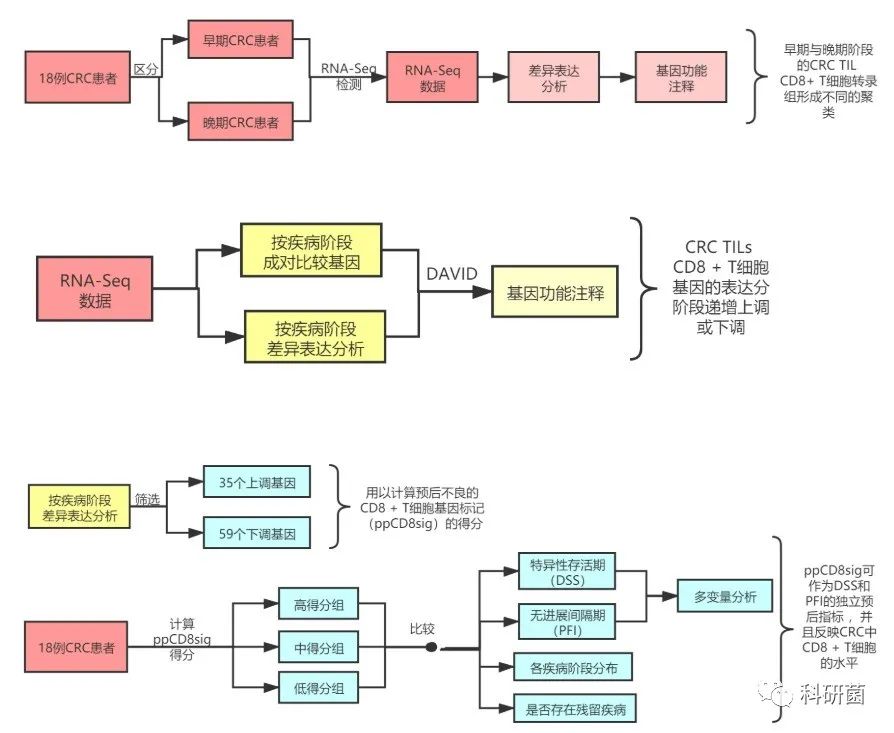
根据疾病的阶段将18例CRC患者CD8 + TIL样本分为两组:早期(E:I和II)和晚期(A:III和IV)阶段,并分别进行RNA-Seq检测,差异表达分析及基因功能注释。
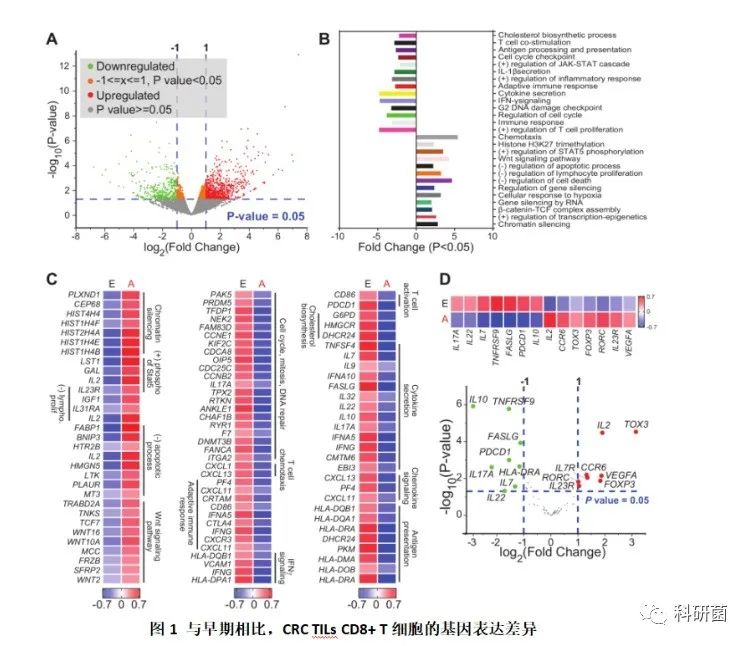
用火山图表示基因在早期和晚期之间的差异表达,红色为显著上调,绿色为下调,灰色则为保持不变(图1A)。
通过比较早期与晚期CRC患者的CD8 + TIL的转录组谱,并在基于DAVID网络的工具中对显著上调和下调的基因(倍数变化> 2和p <0.05)进行功能注释,发现晚期患者CD8 + TILs中上调的基因与细胞趋化性、染色质沉默、细胞缺氧反应、Wnt信号传导以及淋巴细胞增殖和凋亡过程的负调控途径有关;而下调的基因与T细胞共刺激、适应性免疫反应、细胞因子分泌、IFN-γ信号传导、细胞周期和DNA损伤检查点途径有关(图1B)。
以热图的形式注释了相关途径中基因的表达情况(图1C)。
检查了与免疫细胞功能相关的特定基因的表达,并以火山图和热图显示了早期与晚期阶段显著上调和下调的基因及其表达情况(图1D)。
2、CRC进展过程中稳定失调基因的功能富集分析
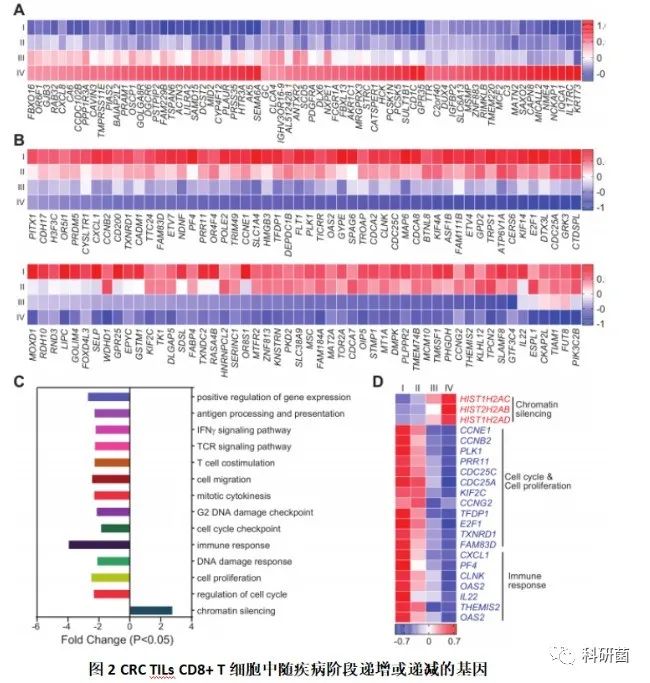
接着分阶段成对比较了I-IV期CRC患者的基因,并进行了差异表达分析(图2A、B)。随着疾病随I–IV阶段的发展,CRC TILs CD8 + T细胞基因的表达分阶段递增或递减。
在DAVID中执行了随着疾病进展稳步上调或下调的基因功能注释(图2C),并用热图显示了根据功能注释显著上调或下调基因的Z score(图2D)。
上调的基因(如HIST1H2AC,HIST1H2AB和HIST1H2AD)在染色质沉默途径中显著富集,而下调的基因(如CCNE1,CCNB2等)在细胞周期和增殖途径中显著富集,或(如CXCL1,PF4等)在免疫应答相关途径的信号传导和T小区共刺激中富集。
3、TCGA分析RNA-Seq数据显示,CRC患者的CD8 + T细胞基因标记不良
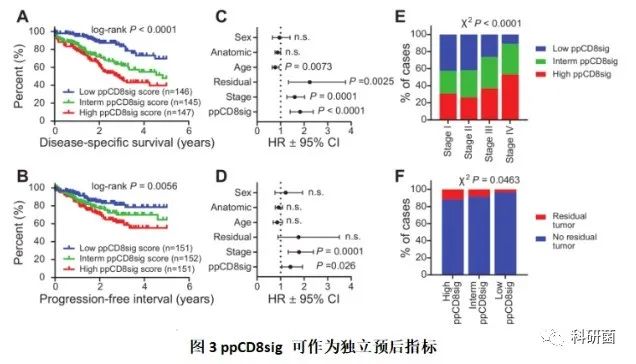
首先,使用35个上调的基因和59个下调的基因来计算“预后不良的CD8 + T细胞基因标记(ppCD8sig)得分”,根据ppCD8sig得分将CRC TCGA病例标记为高,中和低组。同时,在不同组别中比较了疾病特异性存活期(DSS)和无进展间隔期(PFI)的K-M曲线,并进行了Mantel-Cox检验。
接着,使用了Cox比例风险模型进行多变量分析,评估了DSS和PFI分别与预后指征ppCD8sig水平,疾病阶段、是否残存疾病、年龄、解剖位置和性别之间的关系。
然后,用条形图展示ppCD8sig评分高,中或低的患者在疾病各个阶段的分布,并且探究不同ppCD8sig分数的患者与是否存在残留疾病的关系。
与ppCD8sig得分中或低的患者相比,ppCD8sig得分高的患者疾病特异性生存期较差和无进展间隔期较短(图3A、B)。
ppCD8sig可作为DSS和PFI的独立预后指标 (P<0.05,图3C、D) 。
在晚期阶段(III和IV)的患者更可能具有高ppCD8sig得分(图4E),同时,在主要治疗后,患者的高ppCD8sig得分更可能有残留疾病(图4F)。
总而言之,通过TCGA分析,从基因表达谱中鉴定出的基因标记可以预测较差的生存期和更具侵略性的临床病理特征,并且可以反映人CRC中CD8 + T细胞的水平。
4、高分预后不良CD8 + T细胞基因标记与淋巴细胞增殖能力有限相关
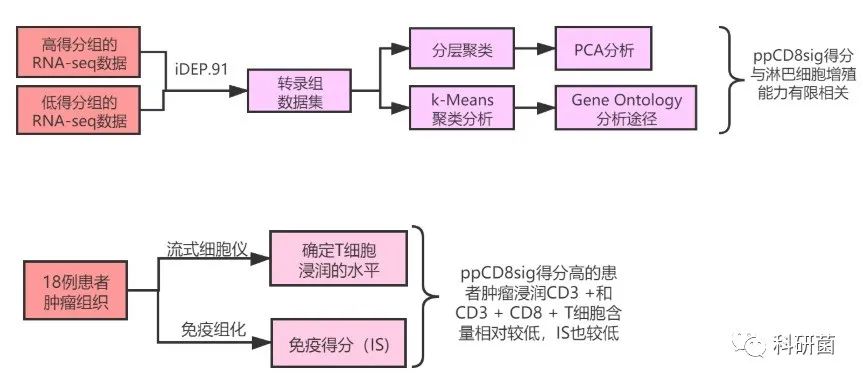
基于Web工具,使用iDEP.91比较了9名ppCD8sig得分高与低的患者的CD8 + TIL转录组的数据集,并且进行分层聚类和PCA分析。差异表达分析显示,高ppCD8sig评分与低评分的患者相比,有1239个上调基因和862个下调基因 (图5A) ;PCA则证实了这些生物复制品的亲缘关系(图5B)。
对数据集进行k-Means聚类分析,将差异表达基因分为两个簇(A和B),通过Gene Ontology分析,发现簇A中上调的基因富含与翻译起始和蛋白质靶向相关的途径,而簇B中下调的基因则富含与细胞周期,染色体分离,有丝分裂细胞周期和细胞分裂有关的途径。
然后进一步比较了ppCD8Sig得分高或低患者的CD8 + TIL转录组, 用热图显示了每个簇的基因表达情况(图5C)。
5、ppCD8sig得分高的患者的肿瘤浸润CD3 +和CD3 + CD8 + T细胞含量相对较低,IS也较低
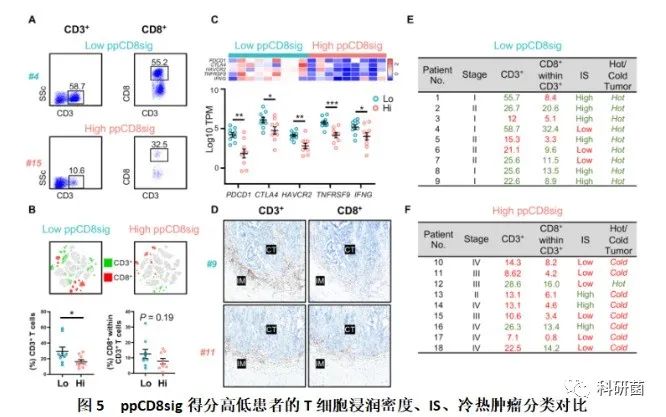
首先,通过分析流式细胞仪数据并确定肿瘤浸润CD3 +和CD3 + CD8 + T淋巴细胞的百分比,来确定T细胞浸润的水平, 这可能反映了ppCD8sig得分高低与患者肿瘤组织中存在的免疫原性程度有关(图6A),并且,t-SNE图中显示高ppCD8Sig得分的患者肿瘤组织中存在更少的CD3 + T细胞浸润(图6B)。
接着,用热图将基因表达的倍数变化表示为Z score,用散点图将基因表达量表示为log 10 TPM,以比较ppCD8sig分数高低与患者CD8 + TIL中免疫检查点基因和IFNG的表达的关系(图6C),发现,与ppCD8sig得分低的患者相比,得分高的患者mRNA表达水平除IFNG(IFN-)外,还显示出较低的CTLA4,PDCD1(PD-1),HAVCR2(TIM-3)和TNFRSF9(4-1BB)。
然后,使用免疫组化确定了ppCD8sig得分高、低的患者的IS类别(图6D),发现ppCD8sig得分低的9名患者中有6名表现出较高的IS(图6E,以绿色显示),而ppCD8sig得分高的9名患者中只有3名具有较高IS(图6F,用绿色显示)。根据ICs和IFN-γ的mRNA表达模式,所有ppCD8sig得分低的患者均表现出“热”肿瘤(癌细胞的周围聚集不少免疫细胞),ppCD8sig得分高的患者中大部分为“冷”肿瘤(癌细胞周围只有很少的免疫细胞)。
这些数据表明,具有高ppCD8sig评分的患者CD3 +和CD3 + CD8 + TILs水平低,IS也较低,可以归类为“冷”肿瘤。相反,低ppCD8sig评分具有较高的CD3 +和CD3 + CD8 + TIL水平,较高的IS和肿瘤,可归类为“热”肿瘤。这些数据进一步证实了所鉴定的基因标记的预后价值,并可能突出其临床相关性。
四、小结
小结
这篇学习笔记的研究思路较简单,然后首先对18例CRC患者的RNA-seq数据进行差异表达分析,分别依据疾病的发展阶段或ppCD8sig得分划分为不同组别进行比较及基因功能分析,然后使用多变量分析和Cox比例风险模型评估ppCD8sig得分的预后意义,最后通过流式细胞仪和免疫染色评估ppCD8sig得分高和低的患者肿瘤中CD3 +和CD8 + T细胞浸润的密度,证实了结直肠癌中所鉴定的ppCD8sig的预后价值。
无相关信息