常卫清与此前获批的其他结直肠癌诊断类产品究竟有何不同?
常卫清与此前获批的其他结直肠癌诊断类产品究竟有何不同?从2020年11月常卫清获批以来,对于癌症早筛第一证的讨论就没有停止过。包括在动脉网公众号有关常卫清报道的留言区中,也时常有读
从2020年11月常卫清获批以来,对于癌症早筛第一证的讨论就没有停止过。包括在动脉网公众号有关常卫清报道的留言区中,也时常有读者询问,常卫清与此前获批的其他结直肠癌诊断类产品究竟有何不同?
虽然诺辉健康已经多次在公开报道中解释了批文上适用范围的不同,但是这毕竟只是诺辉健康的一面之词。能够为药监局批准上市的产品,做公信力背书的,恐怕也就只有国家监管部门。
2021年3月5日,中国器审微信公众号发表了名为《结直肠癌筛查产品国内外现状及临床评价要求》的文章。文中特别针对FIT-DNA检测技术,也就是常卫清所属的产品类别,进行了相关分析,并结合临床需求,总结了结直肠癌筛查产品的临床评价要求。
此次CMDE终于在公开渠道正式发文,常卫清的“癌症早筛第一证”想必不会再有争议。但是围绕着常卫清的相关信息,CMDE又在文中披露了有关早筛产品审批的更多细节。因此我们此次撰文拆解CMDE的这篇文章,希望可以对常卫清身后其他早筛产品的申报有所帮助。
(文中有部分内容为对该文的直接引用,均以“斜体”表示。)
CMDE官方发文,常卫清独一性再无争议
可能有些读者对于CMDE不是特别了解,所以在此先做一下简要介绍。
CMDE,全称国家药品监督管理局器械技术审评中心,是国家药品监督管理局下设的直属机构,负责与医疗器械相关的技术审评、检查、规范制定等多项工作。其中在此处尤其需要强调的是,CMDE的职责之一,正是“申请注册的国产第三类医疗器械产品的受理和技术审评工作”。也就是说,常卫清的申报审批过程中,关键性的技术审评工作,就是由CMDE完成,并且相关产品技术审评报告也已经在CMDE网站上公开。
本次发文的“中国器审”微信公众号,其账号主体正是CMDE官方账号。
CMDE为什么发文?按照文中的说法,主要是因为常卫清的获批上市引起了医疗器械行业的广泛关注,“一方面是由于‘筛查’产品广泛的受众将带来高额的市场价值,另一方面,更多的原因在于临床对于癌症‘早筛早诊’的强烈需求”。
因此在CMDE发布的内容中,除了对于结直肠癌早筛环境的客观描述,还特别分析了FIT-DNA检测技术在结直肠癌筛查中的风险和收益,并结合获批的产品,总结了结直肠癌筛查产品的临床评价要求。
那么CMDE是如何描述常卫清的?
首先,文中直接说明了“此前批准的相关产品均未按照上述要求进行前瞻性的临床试验”,“不足以支持其用作疾病早期筛查方法”;并在全文的结论部分非常明确的指出常卫清是“同类产品首个批准上市的创新产品”。常卫清的唯一性得到了监管部门非常明确的支持。
CMDE在文中大篇幅的介绍了常卫清前瞻性大规模临床试验的相关数据,并明确说明了常卫清的临床意义在于“将高风险人群进一步分层,从而改善高风险人群的结肠镜依从性,促进其获得及时的诊断和治疗,避免因肠镜依从性差而导致疾病进展。同时也使有限的结肠镜资源得到更好的分配”。
这一段话可以简单的概括为,常卫清并不是要替代肠镜,而是最大化利用有限的肠镜资源。
说得更透彻一点,肠镜仍然是结直肠癌筛查的金标准,即使常卫清的临床数据十分亮眼,却仍无法在临床上取代肠镜。但是“我国结肠镜资源匮乏且分布不均,尚不能满足大规模人群筛查的需要”,再考虑到肠镜检查的复杂性和不适感,大量高风险人群无法,或不愿意接受肠镜检查。
此时常卫清就可以作为肠镜检查前的第一道关口。由于极高的阴性预测值(99.6%),大量常卫清检测阴性的人群可以不过多占用有限的肠镜资源,仅在有必要的情况下接受肠镜检查。“与不进行精筛过程相比,高风险人群浓缩了4.8倍,提高了结肠镜检查效率,并有助于改善高风险人群的肠镜依从性”。
官方透露早筛临床评价,聚焦三大指标
除了为常卫清站台,CMDE此文中还以常卫清和此前获批的其他产品为例,阐述了结直肠癌早筛产品的临床评价标准。具体内容还请参考原文中的相关描述,但是我们在将CMDE文中提到的几个评判标准上的关键点提炼,并总结如下。
1.前瞻性入组;
2.入组人群应当针对预期的筛查人群;
3.在临床灵敏度、特异性、阳性/阴性预测值等评价指标中,临床灵敏度和阴性预测值是早筛产品非常关注的性能指标。
具体来说,前瞻性入组和入组人群条件的设置,都是为了与产品的实际使用情况一致。毕竟早筛产品的最终目的是为了在疾病进展的早期发现疾病。如果以已经确诊的患者为基础进行回顾式队列的研究,并不能准确地表明产品在早筛上的有效性。
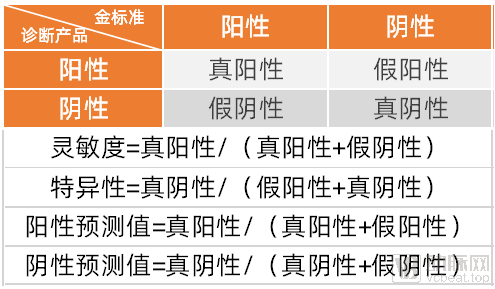
我们总结出的第三点,则更明确的表明了CMDE对于早筛产品的临床试验结果要求。在上图所示的四个数据维度中,CMDE更关心灵敏度和阴性预测值。对应到四个象限中,可以很明显的发现,影响灵敏度和阴性预测值的关键性点,在于假阴性,也就是被诊断产品判定为阴性,但实际金标准阳性的人群,俗称“漏检”人群。
如果假阴性不够低,在实际产品使用过程中,大概率发生的事情就会是,大量的患者因为检测中的假阴性而没有接受金标准的诊断,导致这部分人群虽然使用了早筛产品,但最终还是贻误了最佳治疗时机。这与早筛产品的初衷明显是相悖的。
这也就是为什么参与常卫清临床试验的医生经常会在公开场合强调常卫清的阴性预测值。并不只是因为99.6%的数字好看,更重要的是,对于一个定位于早筛的产品来说,能做到“不漏检”,才是真正的好产品。
所以基于这几项临床试验的相关要求,CMDE在文中也解释了为何此前获批的产品未能被批准为早筛产品,对应上文的三个关键点:
1.“均未按照上述要求进行前瞻性的临床试验”;
2.“仅针对结直肠癌不同分期患者和非结直肠癌患者进行富集入组”;
3.“无法对产品阳性预测值和阴性预测值进行系统性评价。同时产品的灵敏度不能达到较好的水平”。
反观常卫清,以前瞻性临床试验的方式入组了4245例(CMDE数据)结直肠癌高风险人群,实现了对结直肠癌95.5%的灵敏度和99.6%的阴性预测值。同时对进展期腺瘤的检测灵敏度也达到了63.5%,可以有效的帮助降低肠癌发病率,防患于未然。这一系列的数据也帮助常卫清最终拿下了“癌症早筛第一证”。
当然此处仍需强调的是,虽然常卫清的阴性预测值已经很高,但还是没有达到100%。所以“阴性结果并不能完全排除疾病风险,鉴于受试者为高风险人群,因此在必要时仍应建议进行肠镜检查”。
多份指南/共识承认FIT-DNA价值,常卫清临床开闸
在CMDE的本篇文章中还大量引用了发表于《中华胃肠外科杂志》上的《中国结直肠肿瘤早诊筛查策略专家共识》(以下简称“共识”),尤其引用了“共识”中整理成图的结直肠癌筛查防治路径。
结直肠癌是最常见的恶性肿瘤之一,常年位居发病率前三甲。肠癌早筛最大的问题在于在癌症早期,大多数患者并没有明显的症状,因此经常到发现便血才去诊治。而此时的癌症已经发生了进展,需要通过手术才能处理,并且五年生存率并不乐观。
作为结直肠癌筛查的金标准,结肠镜在降低结直肠癌的发病率和死亡率上至关重要。但是由于对技术和设备要求高,并且检查时会带来一定的痛苦和并发症风险,很多国家都没有采用一步法的结肠镜检查,而是通过一些预先筛查手段首先进行患者分层,筛选出结直肠癌高风险人群,再有针对性的进行结肠镜检查。
考虑到我国的结肠镜普及情况,“共识”给出的路径也覆盖了肠镜前的筛查过程。并且前瞻性的将FIT-DNA检测纳入考虑,并将患者分层过程分为初筛和精筛两个阶段。

从图上可以明显看出,问卷风险评估、FIT、FIT-DNA检测和肠镜都能对人群实现结直肠癌的初步筛查。而到精筛阶段,对于风险较高的人群,现有的解决方案中,就只有常卫清对应的FIT-DNA检测能够在肠镜前实现较为精准的人群分层。
FIT-DNA检测的重要性,确实已经在结直肠癌早筛领域形成了广泛的共识。在2021年1月发布的《中国结直肠癌筛查与早诊早治指南(2020,北京)》中同样将“多靶点粪便FIT-DNA”列为了除结肠镜、FIT、乙状结肠镜、结肠CT成像技术之外的第五种结直肠癌早筛方法。
在有关多靶点粪便FIT-DNA的相关介绍中援引了美国此前研究的相关数据。每三年一次多靶点FIT-DNA检测,获益可以达到结肠镜筛查策略的84%,与每5年一次软式乙状结肠镜筛查策略获益相同。基于此,“指南”推荐每3年进行一次多靶点粪便FIT-DNA检测。
借助官方背书和行业共识的力量,诺辉健康下一阶段的关键性目标,将在于优先开拓临床市场。常卫清的官方定价为1996元,作为一款经过大规模临床试验的早筛产品,这是个合理的定价。但是如果从C端用户的视角上看,接近2000元的价格也确实不算便宜。加上此前没有其他早筛产品为常卫清做市场铺垫,想要让C端用户在短时间内接受,并选购常卫清,可能还比较困难。
因此,诺辉健康的市场推广选择了另外一条路线,先从院内入手,再逐渐扩展到院外。首先医生对于早筛重要性的认知是非常明确的,充分的基础知识,也让临床医生可以快速理解常卫清对于结直肠癌早筛的重要意义。其次,会前往医院进行相关咨询或检查的用户,是广大用户中早筛意识比较前卫的群体。这部分群体更容易在听取医生的介绍和建议后,选择常卫清作为肠镜前的筛查选项。
所以常卫清对于早筛市场的重要意义,不止于首证的获批。在临床层面上,早筛产品的临床标准因为首个产品的获批而更加明确;而在市场层面上,诺辉健康则作为探路者在早筛市场中前行。正如我们此前所说的,早筛市场才刚刚开闸,我们期待的不止是常卫清不断取得更好的成绩,更值得期待的是越来越多的产品进入临床,最终让早筛成为诊疗前的常态。
作者:郝翰
上一篇:解读最普遍的皮肤疾病——痤疮
无相关信息