肠道菌群代谢产物氧化三甲胺通过氧化应激促进内皮细胞衰老及血管老化
肠道菌群代谢产物氧化三甲胺通过氧化应激促进内皮细胞衰老及血管老化点击上方「TUST微生态与分子药理实验室」关注我们01文章背景简介BACKGROUND INTRODUCTION高龄
点击上方「TUST微生态与分子药理实验室」关注我们
01
文章背景简介
BACKGROUND INTRODUCTION
高龄是心血管疾病(CVD)发生的关键因素。此外,血管老化是导致CVD高死亡率的最重要的危险因素之一,它影响CVD的阈值、发生过程和严重程度。越来越多的证据表明,细胞衰老影响着血管老化。血管内皮细胞(EC)是血管壁的重要组成部分,对维持心血管稳态至关重要。因此,揭示EC衰老和血管老化的机制可能为防止血管疾病提供重要的治疗策略。
目前已发现多种诱发EC衰老的因素,包括DNA损伤、端粒缩短、氧化应激、线粒体功能障碍等。然而,ECs抵抗各种因素诱导衰老并在环境刺激后维持细胞稳态的机制仍然是一个有待研究的课题。
肠道菌群的代谢产物与CVD的发展之间存在重要关联。有研究表明,细菌衍生的代谢产物可以影响宿主的寿命。越来越多的证据表明,氧化三甲胺(TMAO)是一种微生物依赖的代谢产物,可导致各种CVD发生,如动脉粥样硬化、心力衰竭、中风和高血压。此外,TMAO已被证明与1型和2型糖尿病,慢性肾病和阿尔茨海默病有关。最近的研究表明,随着年龄的增长,大鼠血浆中氧化三甲胺的水平会增加。然而,TMAO含量的升高是否与EC衰老及血管老化有关仍不清楚。
2018年1月,来自北京大学医学部的郑乐民研究组和福建医科大学附属协和医院的洪华山研究组在《Free Radical Biology and Medicine》杂志(IF=5.657,医学二区)发表了题为“Gut flora-dependent metabolite Trimethylamine-N-oxide accelerates endothelial cell senescence and vascular aging through oxidative stress”的文章。
02
所用到的主要方法
METHODS
1.等离子体分析:在禁食12 h后,将血样收集到EDTA抗凝血管中。样品立即以3000 g离心15 min,血浆保存于- 80℃,解冻次数小于3次。
利用全自动生化分析仪,对健康人群空腹血糖(FBG)、天门冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、甘油三酯、胆固醇、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、肌酐和尿素进行分析。
用稳定同位素稀释液相色谱-串联质谱法(LC/MS/MS)对TMAO水平进行定量。将20μL样品添加到含有80μL的内标混合物(甲醇中含10μM d9-TMAO)的1.5mL离心管中。短暂混合后,将混合物在4-8℃下旋转1min,并在-80℃下孵育4h以沉淀蛋白质。在4℃,20000g离心10min后,回收上清液。为了获得精确的TMAO浓度,用相同的程序处理20μL各种浓度标准物(0-100μM),当测定系数(R2)达到0.999时,得到了标准曲线。上清液(70μL)以0.4 mL/min的流速用LC-20 CE岛津泵系统注入硅胶柱,并用一台SIL-20AXR自动进样器连接到API 5500Q捕集器质谱仪。将溶剂A(水中0.1%丙酸)与溶剂B(甲醇中0.1%乙酸)以不同的比例混合,从2%B开始,经5min线性过渡到95%B,然后保持1min,然后还原到2%B,生成不连续的梯度来分解分析物。采用正离子电喷雾电离,分别在m/z 76→58、d9 -TMAO和m/z 85→66的条件下,对前驱体进行多重反应监测,并对TMAO的特征产物转变进行监测。
2.β-半乳糖苷酶(SA-β-gal)染色
3.组织病理学检查
4.免疫组织化学染色法
5.血管功能评估
6.qRT-PCR
7.Western Blotting
03
文章主要内容摘要
ABSTRACT
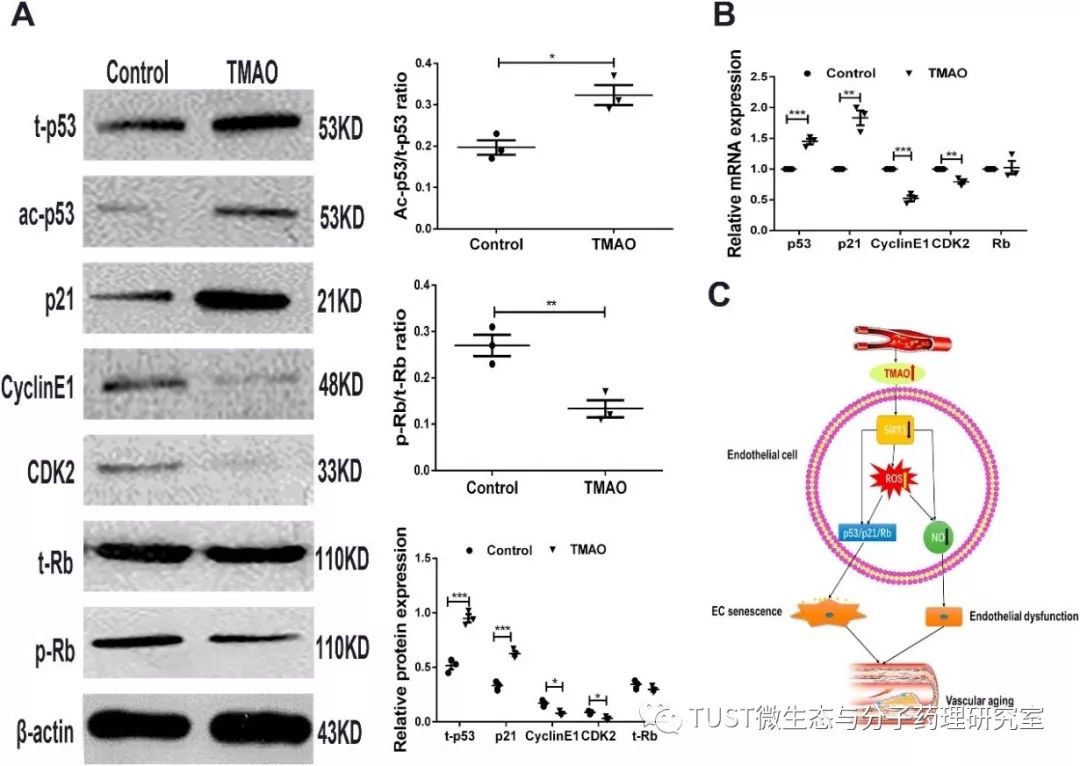
肠道菌群依赖性代谢产物氧化三甲胺,已被证实与心血管疾病有关。然而,目前对TMAO与血管老化之间的关系知之甚少。对此,本文观察了衰老过程中TMAO的变化以及TMAO对血管老化和内皮细胞(EC)衰老的影响。同时分析了年轻人(18-44岁)、老年人(≥65岁)和1个月大、3个月大、6个月大和10个月大的快速老化小鼠(SAMP8)及抗快速老化小鼠(SAMR1)血浆中TMAO的水平。本文发现在人和小鼠体内循环的TMAO水平随着年龄的增长而增加。在TMAO处理小鼠16周后,通过上调衰老标志物(包括衰老相关β-半乳糖苷酶(SA-β-Gal)、p53和p21)、及促进血管功能障碍和重塑,诱导SAMR1小鼠的血管老化,加速SAMP8小鼠的衰老过程。在体外,TMAO的长期处理可诱导人脐静脉内皮细胞(HUVECs)衰老,表现为减少细胞增殖,增加衰老标记物的表达,G0/G1停滞,抑制细胞迁移。此外,TMAO抑制了去乙酰化酶 1(SIRT1)的表达,增加了体内和体外的氧化应激,激活p53/p21/Rb途径,导致p53、p23、p21的乙酰化,并降低了CDK2、cyclinE1和Rb的磷酸化。结果表明:衰老过程中循环TMAO的升高可能会恶化EC衰老和血管老化,这可能与抑制SIRT1的表达和氧化应激的增加有关,从而激活p53/p21/Rb通路。
▼
相关链接
▼
Cell:内皮细胞中NAD+/H2S信号受损是血管老化的可逆性原因
上一篇:8月销量点评:寒冬下奔驰强势领涨
-
Apple Watch 5点亮苹果秋季发布会:细数苹果的医疗健康野心2019-09-14
-
这里有亮点!带您揭秘深圳生物健康和智慧医疗展2019-09-13
-
6大亮点!带您揭秘深圳生物健康和智慧医疗展2019-09-12
-
首日告捷 深圳生物健康和智慧医疗展顺利开幕!2019-09-12
-
安全品质呵护家人健康,乐普小蓝点额温枪居家必备2019-09-12
-
首日告捷 深圳生物健康和智慧医疗展盛大开幕!2019-09-12
-
美年健康财报之史上最全解析(上):平均单店收入大幅下降,内生增长与外延并购均遇挑战!2019-09-12
-
Apple Watch 5点亮苹果秋季发布会,五年三大步,细数苹果的医疗健康野心2019-09-12
-
首日告捷!深圳生物健康和智慧医疗展盛大开幕2019-09-11
-
苹果推出健康研究应用,重点关注心脏与女性健康2019-09-11
-
智能手环 做你的健康小助手2019-09-10
-
小病忍、大病扛?这才是健康的正确打开方式2019-09-09
-
301医院在欧洲心脏病学年会发布基于华为可穿戴设备的心脏健康研究成果2019-09-07
-
苹果、华米、华为下重注!半年14起投资,健康可穿戴设备重回快车道2019-09-06
-
麻省理工开发磁控线性机器人,能在脑血管中自由穿梭2019-09-06