Nature:MAP4K4通过调节整合素与FERM的结合,控制内皮细胞运动能力
Nature:MAP4K4通过调节整合素与FERM的结合,控制内皮细胞运动能力文章背景简介 细胞迁移依赖于细胞与细胞外基质的相互作用。整合素受体可以结合细胞外基质配体并调节细胞
文章背景简介
细胞迁移依赖于细胞与细胞外基质的相互作用。整合素受体可以结合细胞外基质配体并调节细胞骨架和信号变化。当整合素与talin等FERM((protein 4.1, Ezrin, Radixin, Moesin family)结构域蛋白结合时,会增加其与细胞外基质配体的亲和力,整合素会聚集成新生的局灶性复合物并募集额外的蛋白质,形成长而稳定的粘着斑(FAs)。随着细胞的迁移,稳定的FAs将被拆解从而使细胞膜收缩.
MAP4K4(丝裂原激活蛋白激酶4)属于STE20家族激酶,它们广泛表达并影响胚胎发育、炎症等许多生物学过程。MAP4K4会通过未知的机制调节在人体环境中的多种分子途径(包括整合素生物学)。
moesin、ezrin和radixin构成ERM蛋白家族(ERMs),是MAP4K4的底物。与talin一样,ERMs包含一个结合跨膜蛋白的氨基末端FERM结构域和一个结合肌动蛋白的羧基末端尾。磷酸化后,这两个结构域解离并在肌动蛋白和血浆膜之间形成系链,以调节细胞-细胞粘附、内吞、细胞极性和有丝分裂。ERMS定位会影响不同类型细胞的收缩,但它们在这方面的作用机制仍不清楚。
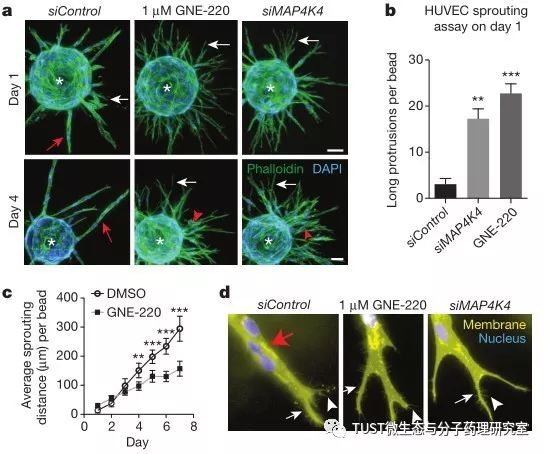
美国Genentech公司及田纳西州St Jude儿童研究医院的Philip Vitorino , Stacey Yeung, Ailey Crow等人2015年在《Nature》杂志上(IF2018= 41.577;1区)发表了题为“MAP4K4 regulates integrin-FERM binding to control endothelial cell motility”的文章。报告了调节内皮细胞运动的新机制:MAP4K4磷酸化moesin,将talin从整合素β1中置换,使整合素β1失活并促进FA的分解,从而在内皮细胞迁移过程中使膜收缩。同时还发现了抑制MAP4K4从而阻碍体内病理血管生成的化学抑制剂,揭示了干预病理血管生成的新方法。
所用到的主要方法
1.3D细胞培养
2.划痕实验
3.EdU检测
4.免疫组化
5.蛋白质印迹分析
6.transwell迁移实验
7.慢病毒转染及稳转细胞系构建
8.实时荧光定量PCR(Q-PCR/Real-time PCR)
9.流式细胞荧光分选技术
10.细胞免疫荧光标记法(immunofluorescence)
11.条件性/诱导性基因敲除MAP4K4小鼠的建立
文章主要内容摘要
细胞迁移是一个多个分子机制逐步协作的过程。本文通过小干扰RNA和化学抑制剂的体外血管生成筛选技术,发现了MAP4K4-moesin-talin-β1-整和素分子途径,该途径在内皮细胞迁移过程中能有效的促进质膜收缩。MAP4K4缺失会降低细胞膜动力学,减缓内皮细胞迁移,并损害体外和体内的血管生成。在迁移的内皮细胞中,MAP4K4可使moesin磷酸化并进而使FA分解,从而使膜回缩。进一步分析表明moesin可在MAP4K4下游通过与talin竞争结合整合素β1胞内结构域来使整和素失活。因此,moesin(由msn基因编码)或map4k4的缺失降低了内皮细胞的黏附分解率。此外,α5β1-整联蛋白阻断逆转了与体外和体内Map4k4缺失相关的膜回缩缺陷。本文研究揭示了内皮细胞迁移的一个新机制。此外,MAP4K4功能丧失可抑制疾病模型中的病理性血管生成,这也表明MAP4K4可作为潜在的治疗靶标。
FGF1对TGF-β1诱导EMT过程的增强作用需要后者引发整合素αvβ3的过表达
-
创想三维:美国科学家用3D打印技术 制造出会“呼吸”的肺2019-06-04
-
喝“千滚水”会中毒?中科协辟谣2019十大科学流言2019-06-04
-
科学家已发现无膜细胞器和神经退行性疾病的相关性——探秘无膜细胞器(上)2019-06-04
-
内皮细胞中NAD+/H2S信号受损是血管老化的可逆性原因2019-06-04
-
Python数据科学:线性回归2019-05-28
-
Python数据科学:决策树2019-05-28
-
科普1分钟 | 剖析吸尘器的心脏:一眼看穿电商产品介绍的猫腻2019-05-28
-
Python数据科学:神经网络2019-05-28
-
时尚智能运动手表,让您运动更科学化2019-05-28
-
径卫视觉:发挥AI大数据平台优势,用科学管理守护道路交通安全2019-05-28