HER2阳性转移性乳腺癌使用trastuzumab deruxtecan的疗效
HER2阳性转移性乳腺癌使用trastuzumab deruxtecan的疗效(医谷讯 12月12日)阿斯利康和第一三共今日公布了针对trastuzumab deruxtecan
(医谷讯 12月12日)阿斯利康和第一三共今日公布了针对trastuzumab deruxtecan (DS-8201)的全球关键性II期单臂临床试验(DESTINY-Breast01)的详细数据。
这是一款靶向HER2的抗体偶联药物(ADC),用于此前接受过两种或两种以上抗HER2治疗的HER2阳性转移性乳腺癌患者。
在接受trastuzumab deruxtecan(5.4毫克/千克)治疗的患者中,经独立中央评估确认,作为主要终点的客观缓解率(ORR)达到60.9%。入组患者此前接受过中位达6线(2-27)的针对转移性疾病的相关治疗。
患者的疾病控制率(DCR)为97.3%,中位缓解持续时间(DoR)为14.8个月,中位无进展生存期(PFS)为16.4个月。试验尚未达到患者中位总生存期(OS),患者一年生存率估计为86%。相关结果在各类患者亚组中保持一致。
丹娜法伯癌症研究所Susan F. Smith女性癌症研究中心乳腺癌研究中心副主任,DESTINY-Breast01试验首席研究员Ian E. Krop表示:“这些结果特别引人注目。Trastuzumab deruxtecan能够在很大程度上帮助患者实现持久的肿瘤减灭,而其中大多数患者已几乎用尽了HER2转移性乳腺癌的所有标准疗法。我们对这些结果感到兴奋,它有望为晚期乳腺癌患者带来帮助。”
试验研究结果
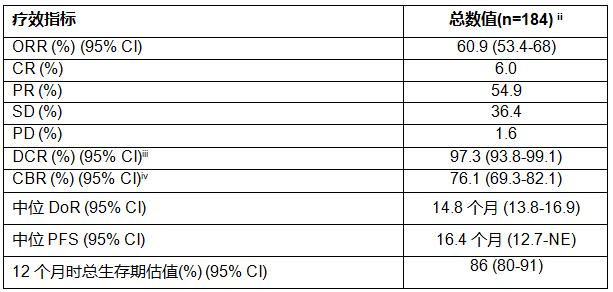
CI,置信区间; CR,完全缓解; PR,部分缓解; SD,稳定疾病; PD,进行性疾病; NE,不可估量。
i经独立中央审查评估
ii 5.4毫克/公斤
iii DCR为(CR + PR + SD)
iv CBR为(CR + PR + SD≥6个月)
相关数据已在2019年圣安东尼奥乳腺癌研讨会上对外发布,并同时在线发布于《新英格兰医学杂志》。
患者此前接受的疗法包括曲妥珠单抗-美坦新偶联物(100%),曲妥珠单抗(100%),帕妥珠单抗(65.8%),其他抗HER2治疗(54.3%),激素治疗(48.9%)以及其他系统性治疗(99.5%)。trastuzumab deruxtecan的中位治疗时间为10个月(0.7-20.5),中位随访时间为11.1个月(0.7-19.9)。截至2019年8月1日的数据,仍有42.9%的患者在接受治疗。
在DESTINY-Breast01试验中, trastuzumab deruxtecan的安全性与耐受性与I期试验中所观察到的保持一致。最常见的3级或更高级别的治疗相关紧急不良事件包括中性粒细胞计数减少(20.7%),贫血(8.7%),恶心(7.6%),白细胞计数减少(6.5%),淋巴细胞计数减少(6.5%)和疲劳(6.0%)。总体而言,通过独立审查确定,有13.6%的患者确诊患有与治疗相关的间质性肺病(ILD)。相关不良事件的严重程度主要为1级或2级(10.9%),仅有一例为3级(0.5%),无4级不良事件。有4例死亡事件(2.2%)被确定归因于ILD。
最近,美国食品药品监督管理局接受了trastuzumab deruxtecan用于治疗HER2阳性转移性乳腺癌患者的上市申请,并授予其优先评审资格。此外,公司还向日本厚生劳动省提交了药品上市申请。
关于HER2阳性乳腺癌
大约五分之一的乳腺癌是HER2阳性乳腺癌。1,2尽管我们看到了药物研发的新进展以及新药物的获批,但晚期HER2阳性转移性乳腺癌的患者仍有大量未满足的治疗需求。3,4在接受目前可用的疗法后,患者最终会出现疾病进展,因此这种疾病仍是无法治愈的。3,4
关于HER2
HER2是一种酪氨酸激酶受体生长促进蛋白,存在于某些癌细胞表面,与乳腺癌患者的疾病侵袭性与不良预后有关。为了判定患者是否为HER2阳性,通常会选择以下两种方法之一来检测,分别是免疫组织化学法(IHC)和荧光原位杂交法(FISH)。IHC测试结果为:0,IHC 1 +,IHC 2+或IHC 3 +。1 IHC3+和/或FISH扩增的结果被认为是阳性的。1
关于DESTINY-Breast01试验
DESTINY-Breast01是一项关键II期,单臂,开放标签,全球,多中心,由两部分组成的临床试验,旨在评估trastuzumab deruxtecan用于先前接受过曲妥珠单抗-美坦新偶联物治疗的HER2阳性不可切除和/或转移性乳腺癌患者的安全性和疗效。试验的主要终点是客观缓解率,由独立中央评估确定。次要目标包括缓解持续时间,疾病控制率,临床受益率,无进展生存期与总生存期。DESTINY-Breast01的患者入组于2018年9月完成,全球100多个中心的184名患者参加了研究。
关于trastuzumab deruxtecan
Trastuzumab deruxtecan(DS-8201;仅在美国为fam-trastuzumab deruxtecan)是第一三共癌症事业部ADC领域的主要在研产品,也是阿斯利康ADC科学平台中最先进的项目。ADC是靶向癌症药物,通过化学键将细胞毒性化学疗法(小分子药物)连接到单克隆抗体上,而单抗作为载体将药物靶向运输到目标癌症细胞中。
一项综合性研究项目正在北美,欧洲和亚洲进行,其中包括针对存在HER2表达的转移性乳腺癌和胃癌患者的5项关键研究,其中一项针对HER2低表达的转移性乳腺癌患者。此外,目前正在进行针对存在HER2表达的晚期大肠癌患者以及转移性非鳞状HER2过表达或HER2突变的非小细胞肺癌患者的各项II期试验。与其他抗癌疗法(例如免疫疗法)联用的相关试验也在进行中。
关于阿斯利康与第一三共之间的合作
2019年3月,阿斯利康和第一三共宣布开展全球合作,在全球范围内共同对潜在新药trastuzumab deruxtecan进行开发与商业化,但第一三共在日本拥有独家权利,且第一三共仅负责药物的制造与供应。
References
1.Tandon A, et al. HER-2/neu oncogene Protein and Prognosis in Breast Cancer. J Clin Oncol. 1989;7(8):1120-8.
2.Sledge G, et al. Past, Present, and Future Challenges in Breast Cancer Treatment. J Clin Oncol. 2014;32(19):1979-1986.
3.de Melo Gagliato D, et al. Mechanisms of Resistance and Sensitivity to Anti-HER2 Therapies in HER2+ Breast Cancer. Oncotarget. 2016;7(39):64431-46.
4.National Comprehensive Cancer Network (NCCN). NCCN Guidelines. Breast Cancer. Available at https://nccn.org. Accessed December 2019.
5.American Cancer Society. Breast Cancer HER2 Status. Available athttps://www.cancer.org/cancer/breast-cancer/understanding-a-breast-cancer-diagnosis/breast-cancer-her2-status.html.Accessed December 2019.
-
颐健安·美奇实时动态血糖仪 全面支撑控糖三角理论 助力糖尿病患者平稳控糖2019-12-11
-
Calquence显著降低初治慢性淋巴细胞白血病患者的疾病进展及死亡风险2019-12-10
-
食管癌免疫治疗迎来“三岔口”,中国患者如何不盲从?2019-12-05
-
新西兰初创公司为乳腺癌患者开发3D打印乳房假体2019-10-09
-
汗液检测替代血检?博哈寿生物发布海拉手环,为糖尿病患者带来“黑科技”2019-09-06
-
4+7新规:增至25省份和25种药品,这些区域的患者将受惠!2019-09-04
-
遇健未来康复平台连接医生、设备及患者,体系化内容视角下的心脑血管康复路在何方?2019-08-22
-
FDA批准首款Ⅱ类医疗器械软件!Oleena帮助癌症患者实现自我管理2019-08-16
-
3D打印心脏瓣膜唤起了特异性治疗患者的兴趣2019-08-02
-
医疗决策就是要多些“患者视角”2019-08-01
-
医疗级智能可穿戴:在医生和患者之间,搭一座信任的桥2019-08-01
-
AtriCure服务超过30万房颤患者,提供三大房颤治疗解决方案2019-07-22
-
有了AI技术,60%的患者可能将免受开刀之苦2019-07-22
-
如何通过打印和移动技术提升患者安全?2019-06-25
-
亚虹医药宣布在美国开展的APL-1202 Ib期临床试验完成所有患者入组2019-06-22