备受争议的阿尔茨海默病药物面临FDA专家组的严格测试
备受争议的阿尔茨海默病药物面临FDA专家组的严格测试一个联邦专家小组将在周五决定是否建议批准一种有争议但有潜力的阿尔茨海默病药物,这将是近20年来第一个进入市场的药物。《纽约时报》
一个联邦专家小组将在周五决定是否建议批准一种有争议但有潜力的阿尔茨海默病药物,这将是近20年来第一个进入市场的药物。

《纽约时报》官网11月6日消息
这种名为aducanumab的药物不能阻止或逆转痴呆症,但一些证据表明,它可以减缓有轻度或早期认知能力下降症状的人的记忆和思维问题的进展,让他们在患上阿尔茨海默病之前有一点额外的时间。这将是第一个通过攻击阿尔茨海默病的核心生物学靶点来达到这一目的的药物。
然而,许多阿尔茨海默病专家怀疑,Biogen公司生产的aducanumab是否已经显示出足够有力的证据,证明它可以减缓认知能力的下降。这种药物需要每月进行静脉注射,而且非常昂贵,每年大约要花费5万美元。一些专家表示,对医生来说,适当地开处方并监督其使用是一项挑战,而批准此类药物将降低患者参与其他可能最终效果更好的阿尔茨海默病药物研究的可能性。
这种药物在临床试验中的道路一直很坎坷,两次3期临床试验中只有一次显示出积极的结果:这些结果是在独立的数据监测委员会于2019年3月停止试验后对额外数据进行分析后得出的,因为这种药物似乎不起作用。
一位74岁的阿尔茨海默病患者的脑CT
包括梅奥诊所(Mayo Clinic)一位神经病学家在内的一些专家表示,证据太过薄弱,目前还无法批准该药物,在决定是否提供该药之前,应该进行另一项严格的临床试验。梅奥诊所的这名神经病学家曾是aducanumab试验的现场调查员。
“完美可能是好的敌人,但对aducanumab来说,证据甚至没有上升到‘好’,”神经病学家David Knopman博士在周五听证会前提交给陪审团的一份评论中写道。Knopman是顾问小组的一员,但由于参与了aducanumab的试验而被听证会撤出。他补充说,“与aducanumab将帮助到阿尔茨海默病患者的希望相反,有证据表明,aducanumab不会带来任何改善,它将伤害一些使用它的人,并将消耗大量资源。”
该专家顾问组是一个由医学专家组成的委员会,向FDA提出建议,将审查aducanumab有效性和安全性的证据。即使FDA在周五批准了该药物,也不能保证其获得批准,但FDA通常会听从其顾问小组的建议。
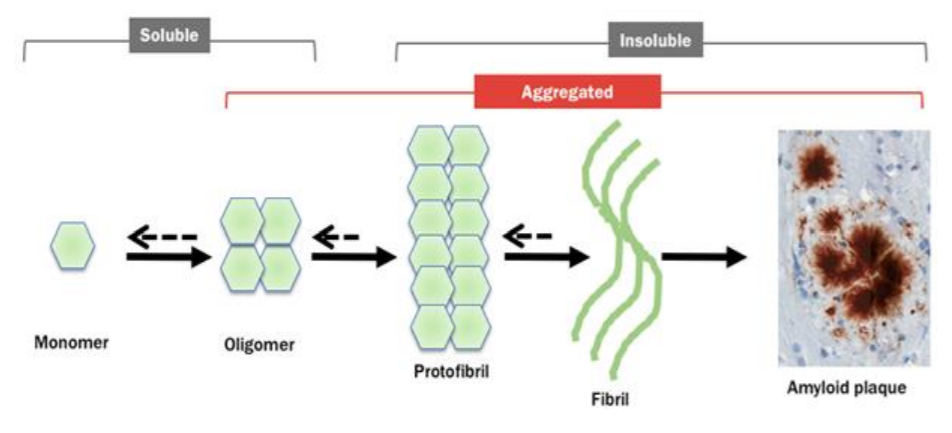
β-淀粉样蛋白途径的描述
美国有近600万人患有阿尔茨海默病,全球约有3000万人,预计到2050年,这一数字将增加一倍以上。如果获得批准,aducanumab可能成为一种潜在的药物,治疗大约200万美国人,这些人估计患有与阿尔茨海默病相关的轻度认知衰退。
它的可用性将产生惊人的影响——不仅对病人,而且对医生、研究人员和其他制药公司以及医疗保健成本。它也将成为Biogen的重磅炸弹药物。
Aducanumab是一种单克隆抗体,针对在阿尔茨海默病中聚集成斑块的β-淀粉样蛋白。许多其他减少淀粉样蛋白积累的药物尚未显示出对症状有所帮助,因此如果aducanumab被确定有效,它将支持一个长期以来的理论,即在疾病过程中,当记忆和认知困难仍然轻微时,如果足够早地攻击淀粉样蛋白可以有所帮助。
该药物将是其制造商Biogen的重磅炸弹,但一些专家说,证据还太弱,不足以保证FDA现在批准。《纽约时报》报道
FDA在听证会前发布的文件给人的印象是,该机构的大多数审查员都满意于成功试验的数据强有力,以及主要涉及一种脑肿胀(brain swelling)的安全问题是可控的。
“申请人提供了支持批准的有效证据,”FDA神经病学临床分析师Kevin Krudys在提交给委员会的陈述中写道。
但另一位FDA审查员在文件中表达了担忧。FDA的数学统计学家Tristan Massie写道,他认为“没有令人信服的、实质性的证据表明治疗效果或疾病减缓,需要进行另一项研究。”
其他专家表示,该试验所宣称的益处程度是轻微的,在超过18个月的时间里,3分认知量表的下降速度减缓了0.5分。

FDA和PCNS药品咨询委员会联合通报文件
斯坦福记忆障碍中心(Stanford Center for Memory Disorders)的医学主任Michael Greicius 博士说:“我的观点是,它没有任何作用,”他补充说,他可能会阻止患者服用。“对于那些说‘哦,来吧,没关系-如果有一点帮助,为什么不试试呢?’我的回答是没有数据告诉我这种药物在阿尔茨海默病中有效。”
另一方面,美国阿尔茨海默病协会(Alzheimer 's Association)给小组写了一封信,支持批准。信中说,FDA应该要求进行上市后研究,但应该在此期间提供这种药物。
该协会首席战略官Joanne Pike写道:“尽管试验数据在科学界造成了一些不确定性,但必须在这一点上与这种疾病在缺乏治疗的情况下会对数百万美国人造成什么影响的确定性进行权衡。数以百万计的人将失去推迟衰退的潜在可能性,那些配偶、伴侣、母亲、父亲、祖母、祖父、阿姨、叔叔、朋友和邻居失去的时间将无法挽回。考虑到这些因素,我们敦促批准。”
班纳阿尔茨海默病研究所(Banner Alzheimer’s Institute)执行主任Eric Reiman博士是其他抗淀粉样蛋白药物研究的联合领导者,但没有参与过aducanumab的研究。他说,顾问小组面临着一个“非常不寻常和重要”的情况,因为临床试验在预定的2021年完成之前就已经停止了,那时的研究结果可能更加明确。
他说:“他们需要做出一个所罗门式(需要运用大智慧,特别是在做出困难的决定时)的决定,一项研究显示出非常有希望的效果,而另一项研究则没有显示出效果。我认为这是一个具有挑战性的决定,因为每个人都想为病人和家人做最好的事情。”

免责声明
本公众号上的医疗信息仅作为信息资源提供与分享,不用于或依赖于任何诊断或治疗目的。此信息不应替代专业诊断或治疗。在做出任何医疗决定或有关特定医疗状况的指导之前,请咨询你的医生。
-
甜菜根肽可能是自身免疫性疾病的良好候选药物2020-11-02
-
WHO称:瑞德西韦作为新冠治疗药物几乎无效2020-10-25
-
瑞德西韦作为第一个新冠治疗药物上市,却不能治愈新冠肺炎!2020-10-25
-
FDA批准首个新冠药物瑞德西韦,吉利德盘后涨近4%2020-10-23
-
对抗致死率90%的埃博拉病毒 全球首款治疗药物获批2020-10-19
-
首款埃博拉治疗药物!再生元中和抗体组合疗法Inmazeb获批上市2020-10-16
-
志道完成亿元融资,推进细胞因子药物临床开发2020-10-16
-
电子血管:促进血液流动,协助药物输送2020-10-04
-
药物如何精准命中癌细胞?2020-10-03
-
新通药物完成Pre-IPO轮逾亿元人民币融资2020-09-19
-
塔吉瑞完成近亿元战略融资,研究开发最新一代靶向药物2020-09-19
-
Dogma科学家团队致力于研发出一种方便供口服的PCSK9药物2020-09-18
-
以毒攻毒!蜜蜂毒素只需60分钟即可100%杀死乳腺癌细胞,与化疗药物联用效果更佳2020-09-14
-
Exscientia与华东医药建立合作开发伙伴关系 加速抗肿瘤药物研发2020-09-13
-
Exscientia与华东医药将合作研发加速抗肿瘤药物2020-09-12